Los Inicios del análisis de suelo
Desde el año 50 A.C. en la Antigua Roma se hicieron los primeros intentos por analizar el suelo; este diagnóstico consistió en pruebas de sabor, acidez y salinidad. Se llegó a pensar que el contenido total de nutrientes en los suelos era lo que interesaba saber, de modo que más tarde se supo que este contenido no correlacionaba con su disponibilidad.
La Evolución del análisis de suelo
Son tres los períodos que definen el desarrollo del análisis de suelo en la época moderna. 1) 1845 a 1906. Se sentaron las bases del análisis moderno de suelos, se evaluaron y desarrollaron procedimientos para evaluar la fertilidad del suelo, ya hubo una primera distinción entre nutrientes menos solubles y más solubles y se empezaron a evaluar extractantes como agua carbonatada, ácido Clorhídrico, ácido acético y ácido nítrico (HNO3). 2) 1907 a 1924. Este período estuvo muy centrado entre la composición química del suelo y la producción del cultivo, se generó una abundante base de datos que sirvió como fundamento para mejorar los métodos analíticos y para interpretar resultados de los análisis de suelos. Fue durante este período que se promovió el monitoreo de la fertilidad del suelo para evitar el agotamiento del mismo. 3) 1925 a 1950. Durante este período se desarrollaron dos corrientes: Una, en la que unos investigadores promovieron el uso de soluciones extractoras multi-elementales y otra, en la que se promovió el uso de soluciones extractoras para nutrimentos específicos. Chapman y Kelly (1930) desarrollaron la solución extractora del acetato de amonio 1 M para las bases de cambio (Ca, Mg, Na y K), solución extractora que en la actualidad se sigue utilizando con excelentes resultados. Morgan (1941) desarrolló la solución extractora universal que lleva su nombre, utilizando ácido acético y acetato de sodio a pH 4.8. Al mismo tiempo Bray y Kurtz (1945) desarrollaron varios procedimientos para evaluar fósforo disponible utilizando fluoruro de Amonio + ácido clorhídrico, los cuales se siguen utilizando hoy en día para la determinación conocida como Bray P1 y P2, en el segundo caso, con una mayor concentración del HCl.

|
Figura 1. Justus Von Liebig (1803-1873) a mediados del siglo XIX con su ley del mínimo permitió sentar los principios de la nutrición vegetal. |
Mehlich (1953) desarrolló el extractante multi-elemental utilizando ácido sulfúrico y ácido clorhídrico, conocido como el método del doble ácido o método de Carolina del Norte. Por su parte, Olsen et al. (1954) desarrollaron el extractante a base de bicarbonato de sodio a pH 8.5, el cual ganó popularidad para los suelos alcalinos y es un método muy popular hoy en día en América y parte de Europa, para suelos neutros y alcalinos. Otros métodos fueron mostrando su ineficacia, como el agua carbonatada, que aún hoy en día existen laboratorios que lo utilizan y el método de Mehlich 2 que tampoco mostró suficiente efectividad y ha sido descartado prácticamente en casi todos los laboratorios.
Tendencias en los análisis de suelo
La búsqueda de soluciones extractoras universales sigue siendo un tema que inquieta a muchos laboratorios, ya que junto con la aparición de los espectrofotómetros de emisión por plasma (ICP) es posible analizar cientos de muestras en un solo día (Mallarino y Sawyer, 1999). Esto hace el análisis muy económico, sin embargo la historia reciente nos ha dicho que se sacrifica demasiado la calidad del diagnóstico, pues se pierde precisión al intentar con un solo extractante evaluar la disponibilidad de los 12 elementos: nitratos (NO3), fósforo (P), potasio (K), calcio (Ca), magnesio (Mg), sodio (Na), azufre (S), hierro (Fe), zinc (Zn), manganeso (Mn), cobre (Cu), boro (B) y en el caso de los suelos ácidos: aluminio (Al) e hidrógeno (H). Algunas referencias que fundamentan la baja eficiencia de los métodos multielementales como Mehlich 3, se citan a continuación:
Para interpretar el análisis de fósforo es necesario saber el método de análisis de suelo antes de que se derive cualquier recomendación de fertilización. Esta consideración es imprescindible ya que se han desarrollado muchos métodos para probar la disponibilidad de fósforo para los cultivos. Así, algunos laboratorios están interesados en el empleo de pruebas que no utilicen extracciones recomendadas tradicionalmente para P. Aquí es donde subyace la cuestión de si el método Mehlich 3 es eficiente o no. Para discutirlo es necesario primero recodar que el resultado del análisis de un laboratorio es la culminación de todo el método de análisis de suelo, incluyendo la extracción y el método de medición analítica. Mehlich 3 es un extractante mutielemental y los nutrientes son medidos en ICP. El Comité Central Regional para Pruebas de Suelos y Análisis de Plantas de Estados Unidos (NCR 13), y la Universidad Estatal de Iowa (Iowa State University, ISU) no recomiendan la determinación de fósforo con el método ICP, extraído con Mehlich 3, pues las variaciones de las concentraciones de P medidas con ICP en comparación con el método colorimétrico estándar miden hasta un 40 % más P, y hacer correcciones en este sentido no es una estrategia eficaz. Además no recomiendan el uso de Mehlich 3 para determinar Calcio (Ca), Magnesio (Mg) y Capacidad de Intercambio Catiónico (CIC) en suelos calcáreos y de micronutrimentos en cualquier tipo de suelo, debido a la falta de correlación. Las interpretaciones de micronutrientes, en particular del zinc, se basa en pruebas de DTPA y para los requerimientos de cal en el método conocido como SMP, desarrollado por Shoemaker, McLean y Pratt en 1961. Para cada región geográfica la ISU recomienda sólo emplear los métodos autorizados y calibrados en esos suelos, esto significa el reconocimiento tanto de la extracción del laboratorio y método de análisis químico (Mallarino y Sawyer, 1999). Por su parte Pittman et al, 2004 realizando pruebas con 6400 muestras de suelo en la Universidad Estatal de Oklahoma, encontraron claras diferencias entre analizar Mehlich 3 con ICP y Mehlich 3 con el método colorimétrico. A pesar de esto, muchos laboratorios utilizan el Mehlich 3-ICP para análisis de fosforo, sin considerar que esta práctica podría llevar a la mala aplicación de nutrimentos y contribuir a pérdidas de cosechas o efectos ambientales negativos. Kleinman et al., 2015, sugieren que la obtención de factores o ecuaciones de corrección no es un asunto trivial, pues las relaciones están potencialmente influenciadas por el tipo de suelo, y factores como el pH del suelo y materia orgánica.
En suelos de Ohio las recomendaciones de fertilización fosfórica en los cultivos se basan en el método de Bray-Kurtz P1-colorimétrico. Comese et al., 2007 trabajando en rotaciones de maíz, trigo y soya con dosis crecientes de fertilizantes fosfatados encontraron que el método Bray &Kurtz I es el que mejor se adapta a las prácticas de diagnóstico y recomendaciones regionales de uso de fertilizantes fosforados. Concluyeron que Mehlich 3 sobreestima el valor a partir de 15 ppm de P en el suelo. Bray & Kurtz I es el método que mejor detectó la variación de las dosis agregadas de fosforo.
Realizando calibraciones de potasio con Mehlich 3 en maíz y soya para suelos de Iowa, Barbagelata et al., 2002 detectaron la necesidad de ajustar los niveles de K para interpretar y hacer recomendaciones de fertilización, concluyendo que la investigación debe estar centrada en proporcionar información para el establecimiento de diferentes interpretaciones de K para diferentes suelos.
En Brasil, un estudio realizado por Carmo et al., 2011 en el cultivo de trigo donde se evaluaron diferentes extractantes para micro nutrimentos (Cu, Zn, Fe y Mn), entre ellos Mehlich 3 y DTPA, encontraron que Mehlich 3 era menos eficiente en la estimación de Zn y Fe disponible para las plantas, por su parte el método DTPA fue el agente de extracción más indicado. Para el caso del boro, Mehlich 3 es un extractante problemático, pues contiene fluor que puede liberar B del vidrio de borosilicato, o el B puede ser absorbido por el vidrio y se adsorbe en un momento posterior. Incluso con el uso de recipientes de plástico, el análisis de B con ICP-AES es propenso a dificultades debido a que el nebulizador de vidrio y la antorcha está en contacto con la solución antes de entrar en el plasma (Sikora y Moore, 2014).
Considerando lo anterior, los métodos de diagnóstico que usan al menos 6 extractantes: Cloruro de potasio para extraer Nitratos; Acetato de amonio para extraer Calcio, Magnesio, Sodio y Potasio; Método del DTPA para extraer Fierro, Cobre, Zinc y Manganeso; Agua caliente para extraer Boro, Cloruro de potasio para extraer Azufre, y en el caso de los suelos ácidos, cloruro de potasio para extraer Aluminio e Hidrogeno, han resultado mucho más efectivos para diagnosticar la fertilidad del suelo. Con los métodos multi-elementales se redujeron los costos pero se perdió precisión. Por esta razón debe buscarse un balance entre rapidez, costo y la efectividad del análisis. Los análisis específicos, es decir, aquellos que usan 6 o 7 soluciones extractoras, son un poco más costosos por la cantidad de trabajo y reactivos que involucran, pero sin duda alguna son muy superiores y mucho más eficientes para diagnosticar la fertilidad del suelo, además de dar más información al usuario, de gran utilidad al momento de implementar la recomendación de la fertilización.
Los análisis de suelo en México
Debido al bajo costo del método de Mehlich 3, se ha propiciado que laboratorios extranjeros que operan en México promuevan su uso en el país. Sin embargo, los especialistas en suelos del país no han aprobado dicho procedimiento por no estar correlacionado ni calibrado en México y por no tener la evidencia de que funciona correctamente para la mayoría de los suelos mexicanos. Su uso permite abaratar el costo de los análisis pero se reduce la eficiencia en el diagnóstico con respecto a los métodos aprobados por la Norma Oficial Mexicana (NOM-021-RECNAT-2000). Incluso en los Estados Unidos, son muchos más los laboratorios que usan hasta 6 extracciones para diagnosticar la fertilidad del suelo que aquellos que usan el método de Mehlich 3 (Sikora y Moore, 2014), por las mismas razones que aquí exponemos.
Por otro lado, la comunidad científica de edafólogos mexicanos se inclina por no recomendarlo como método de diagnóstico de la fertilidad del suelo, pues la ausencia de correlación y calibración en el ámbito regional de un método determinado le resta valor para su uso como herramienta de diagnóstico de la fertilidad del suelo. Esto es vital para mantener la credibilidad en los análisis de suelos ante los usuarios. Es vital que los laboratorios mexicanos se apeguen a las metodologías de análisis que marca la Norma Oficial Mexicana.
Conceptos de correlación y calibración
Para que un procedimiento de análisis de suelo sea autorizado para su uso debe cumplir el siguiente desarrollo: 1) La evaluación de varias soluciones extractoras y métodos de análisis; 2) Correlacionar el rendimiento del cultivo o la cantidad del nutriente extraído por el mismo, con la cantidad de nutriente extraído por cada una de las soluciones extractoras; y 3) Calibración del procedimiento analítico, que consiste en estimar la concentración del elemento extraído a la cual ya no se observa una respuesta en rendimiento, es decir, estimar el nivel crítico, por encima del cual es improbable la respuesta al nutriente en cuestión.
Con adecuada precisión la correlación define el método analítico que mejor refleja el contenido del nutrimento disponible en el suelo en relación al crecimiento del cultivo y predice con mayor precisión la respuesta del cultivo a dicho nutriente. El grado de correlación puede variar con la clase de suelo.
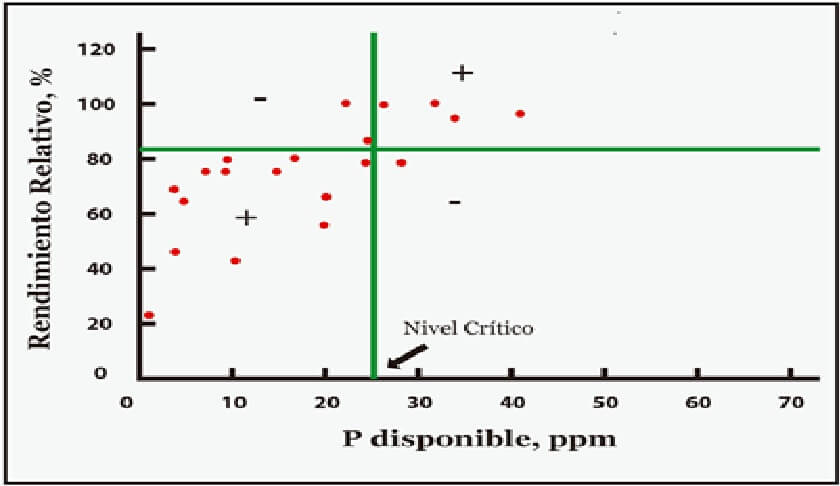
Por otra parte, la calibración es el proceso mediante el cual se establecen los niveles considerados como críticos. El procedimiento más usado para definir los niveles críticos es el propuesto por Cate y Nelson (1971), cuyo diagrama se presenta en la Figura 2. Posteriormente con otros estudios estadísticos de regresión, más detallados, se propone una serie de valores interpretativos que van desde muy bajo o
|
Figura 2. Ejemplo del Diagrama de dispersión entre el rendimiento relativo y el contenido de P-Bray en el suelo, que muestra el nivel crítico por el procedimiento de Cate-Nelson (1971). |
deficiente, hasta muy alto o excesivo. Sin estos valores no se pueden interpretar los análisis de suelo. En la Figura 3 se presentan las características de estos niveles, los cuales Fertilab respalda con su propia investigación. Un método no calibrado ni correlacionado en campo, arroja resultados poco confiables y hay reportes de que aun en los Estados Unidos, hay muchas regiones donde el método de Mehlich 3 no ha sido correlacionado ni calibrado y en el mejor de los casos solo se han hecho correlaciones con los métodos convencionales, para estimar un factor de conversión y poder establecer los niveles de suficiencia para fines de interpretación.
Métodos de diagnóstico autorizados en México
En el mes de octubre del año 2000 el Diario Oficial de la Federación publicó la Norma Oficial Mexicana 021-RECNAT-2000, la cual establece las especificaciones de fertilidad, salinidad y clasificación de suelos, estudios, muestreo y análisis con aplicación en todo el territorio nacional. Esta norma tiene como propósito que los proveedores de servicios de análisis estén debidamente regulados, con la finalidad de proporcionar a los usuarios un servicio de calidad y de alta confiabilidad en la información analítica, evitando que cada laboratorio use el método que mejor le convenga por razones de bajo costo. A continuación se muestra un resumen de las metodologías autorizadas por la NOM 021 para su uso en México.
N-Nítrico (N-NO3). Es el N del suelo que está disponible para su uso inmediato por el cultivo. Se extrae mediante una solución extractora de KCl, seguida de la destilación con arrastre de vapor. También se puede estimar mediante el método de la columna de reducción de cadmio.
Fosforo (P). Se determina mediante los Métodos de Olsen (suelos neutros o calcáreos) y Bray 1 (Suelos ácidos o neutros). Los niveles críticos van de 10-15 ppm para el método de Olsen y 25-30 ppm para el método de Bray 1.
Potasio (K), Calcio (Ca), Magnesio (Mg) y Sodio (Na). Estos cationes se extraen con acetato de amonio 1 N a pH 7 y se cuantifican por Absorción Atómica o mediante ICP. En suelos calcáreos se recomienda extraer con acetato de amonio 1 N a pH de 8.5, para evitar sobreestimaciones de Calcio y Magnesio. .
Hierro (Fe), Manganeso (Mn), Zinc (Zn) Cobre (Cu). Son extraídos con DTPA y cuantificados por Absorción Atómica o mediante ICP. El nivel crítico considerado para Fe y Mn es del orden de 5 ppm, para Zinc 1 ppm y para cobre va de 0.5 a 1 ppm.
Boro (B). Se extrae mediante una solución caliente y diluida de CaCl2 y se cuantifica mediante ICP o Azometina H. Su nivel crítico es del orden de 0.8 a 1 ppm y el nivel excesivo es mayor a 4 ppm.
Azufre (S). El método es semicuantitativo. El S se extrae con KCl y la determinación se realiza en forma turbidimétrica. EI nivel crítico es de 5-10 ppm.
Como se mencionó al inicio, el uso de soluciones extractoras específicas es la forma más acertada y precisa para la determinación de nutrientes en el suelo. Un laboratorio apegado a la NOM y con un riguroso control de calidad permite otorgar a los usuarios diagnósticos asertivos.
El control de calidad en los laboratorios
El control de calidad y el uso de metodologías apropiadas permiten a los laboratorios mantener la certeza en los análisis que ofrecen. El análisis de suelo que ofrece un laboratorio confiable es una guía robusta para recomendar las dosis de fertilización, pues es la base para asegurar un exitoso programa de fertilización. De esta idea deriva la importancia de un diagnóstico asertivo y de calidad, pues de él dependerá que se tomen decisiones correctas en materia de nutrición vegetal. El establecimiento y seguimiento de un riguroso control de calidad es la única forma que define “confiabilidad” en los laboratorios.
La normativa tiene como propósito supervisar el desempeño de los laboratorios, donde el Control de Calidad Interno y Externo son parte importantísima del proceso. La intercomparación permite medir y estandarizar procesos con laboratorios internacionales como parte del control de calidad externo.
Adicionalmente se lleva a cabo un control de calidad interno, mediante el uso de patrones certificados, que permiten asegurar la certidumbre en el análisis. Estos patrones de concentración conocida para cada uno de los elementos analizados y el uso de blancos, se corren en cada lote de 10 muestras y permiten asegurar la certidumbre del análisis en las muestras que recibimos de nuestros clientes. Los datos son analizados estadísticamente y permiten generar los rangos e intervalos de trabajo, así como los criterios de validación de la determinación. Este proceso se denomina control estadístico del proceso (CEP), el cual también se utiliza en la industria automotriz desde hace muchos años.
¿Cómo elegir los servicios de un Laboratorio?
A continuación se citan 11 criterios que sirven de guía para una acertada elección de un laboratorio. 1) Revisar cuantas y cuales determinaciones realiza el laboratorio, 2) Que tiempos de entrega ofrece al usuario, 3) Revisar si está certificado en ISO-9001-2008, 4) Si cuenta con acreditaciones internacionales, 5) Si cuenta con intercalibraciones con diferentes laboratorios en el mundo, 6) Si usa las metodologías de análisis propias para México y que marca la NOM, 7) Si realiza investigaciones de sus métodos, 8) Si usa patrones certificados, 9) Si usa muestras patrón por cada 10 análisis, 10) Si dispone de un reporte amigable y 11) Si otorga una interpretación y una recomendación de la fertilización sin costo para el cliente.
Los altos rendimientos en los cultivos son el resultado de múltiples factores que se inician con un buen diagnóstico de la fertilidad del suelo. Es importante utilizar un adecuado sistema de muestreo, un buen procedimiento de análisis, autorizado por la norma oficial mexicana, y un buen control de calidad analítica en el laboratorio. El siguiente paso es llevar a cabo una buena interpretación de los resultados de los análisis y posteriormente generar una adecuada recomendación de la fertilización, a partir de una meta determinada de rendimiento.
Fuentes consultadas:
- Mallarino, A.P.; Sawyer, J.E. 1999. Differentiating and Understanding the Mehlich 3, and Olsen Soil Phosphorus Tests. Departament of Agronomy. Iowa State University. 6 p.
- Carmo, M.; Mansano, M.V.; Steiner, F. 2011. Assessment of Micronutrient Extractants From Soils of Paraná, Brazil. R. Bras. Ci. Solo, 35: 2093-2103.
- Pittman, J.J.; Schroder, J.L.; Zhang, H. 2004. Differences of Phosphorus in Mehlich 3 Extractants Determined by Colorimetric and Spectroscopic Methods. Soil Science and Plant Analysis, 36: 1641-1659.
- Kleinman, P.; Mallarino, A.P.; Pierzynski, G.; Sullivan, D.; Wolf, A.; Zhang, H. 2015. Phosphorus Determination in Waters and Extracts of Soils and By-Products: Inductively Coupled Plasma Spectrometry versus Colorimetric Procedures. Southern Extension and Research Activity (SERA) – 17. Consultado el 10 de Abril de 2015. (http://www.sera17.ext.vt.edu/).
- Barbagelata, P.A.; Mallarino, A.P.; Wittry, D.J. 2002. Iowa Soil-Test Field Calibration Research Update: Potassium and the Mehlich-3 ICP Phosphorus Test. Departament of Agronomy, Iowa State University, Ames, Iowa. 11 p.
- Mullen, R.; Watson, M. 2007. Understanding Soil Tests for Plant-Available Phosphorus. The Ohio State University. 4 p.
- Sikora, F.J.; Moore, K.P. 2014. Soil Test Methods From the Southeastern United States. Southern Cooperative Series Bulletin No. 419. 219 p.
- Comese, R.; González, M.; López, M.V.; Madero, M.; Moreno, G. 2007. Comparación de los Métodos de Bray & Kurtz 1 y Mehlich III en la Determinación de la Disponibilidad de Fósforo en Suelos con Fertilizaciones Continuas. CI. SUELO (ARGENTINA), 25(1): 23-29.
- Bray, R.H.; Kurtz, L.T. 1945. Determination of Total, Organic, and Available Forms or Phosphates in Soils. Soil Sci. 59: 39-45.
- Chapman, H.D.; Kelly, W.P. 1930. The Determination of the Replaceable Bases and Bases Exchange Capacity of Soils. Soil Sci. 30: 391-406.
- Morgan, m.f. 1941. Chemical Soil Diagnosis by the Universal Soil Testing System. Connecticut. Agric. Exp. Bull. 450. Univ. of Connecticut, Storrs. USA.
- Mehlich, A. 1953. Determination of P, K, Na, Ca, Mg y NH4. Soil Test Div. Mimeo. North Carolina Dep. Agric., Raleigh. USA.
- Olsen, J.K.; Cole, C.V.; Watanabe, F.S.; Dean, L.A. 1954. Estimation of Available Phosphorus in Soils by Extraction with Sodium Bicarbonate. USDA. Circ. 939. US Gov. Print. Office. Washington, D.C.
- Cate, R. B., Jr.; Nelson, L.A. 1971. A Simple Statistical Procedure for Partitioning Soil Test Correlation into Tow Classes. Soil Sci. Soc. Am. Proc. 35: 658-659.



Aún no hay comentarios sobre el artículo