El cultivo in vitro consiste en tomar una porción de una planta (ej. el ápice, una hoja o segmento de ella, segmento de tallo, meristemo, embrión, nudo, semilla, antera, etc.) y colocarla en un medio nutritivo estéril (usualmente gelificado, semisólido) donde se regenerará una o muchas plantas. Durante las últimas décadas, la técnica del cultivo “in vitro” ha ganado especial interés para el establecimiento de diversas plantas para la producción de compuestos o la obtención de cultivos más sanos y con características genéticas específicas.
El cultivo in vitro de vegetales se basa en el aislamiento de órganos, tejidos o células vegetales y en el ajuste de las condiciones necesarias para la obtención de respuestas fisiológicas o morfogénicas a partir de estos explantes (Höxtermann, 1997). El cultivo de células y tejidos in vitro (CCTV) involucra diferentes técnicas a partir de diferente material vegetal tales como cloroplastos, células, tejidos, órganos e incluso plantas completas.
La totipotencia es la capacidad de una célula de generar un individuo completamente idéntico a la célula madre, la cual tiene la misma información genética y la misma función (Kieran & Col, 1997), es decir, indica que cualquier célula vegetal contiene una copia íntegra del material genético de la planta a la que pertenece sin importar su función o posición en ella, y por lo tanto tiene el potencial para regenerar una nueva planta completa (Ferl y Paul, 2000).
El CCTV es una forma de reproducción asexual, la cual se puede realizar gracias al mecanismo de división mitótico de las células vegetales. La división celular mitótica implica una replicación de los cromosomas de las células hijas, por lo que poseen un genotipo idéntico al de la célula madre. La potencialidad de una célula diferenciada para generar tejidos nuevos y eventualmente un organismo completo, disminuye con el grado de diferenciación alcanzado por esa célula, pero puede revertirse parcial o completamente según las condiciones de cultivo a las que se la someta. De este modo y desde la óptica de la conservación de especies vegetales la aparición de la variación espontánea no controlada y al azar durante el proceso del cultivo in vitro se convierte en un fenómeno inesperado y no deseado en la mayoría de los casos. Contrariamente a estos efectos, su utilidad en la mejora de los cultivos mediante la creación de nuevas variantes también ha sido bien documentada (Bouharmont, 1994; Mehta y Agra, 2000; Predieri, 2001).
.jpg)
|
Figura 1. Propagación in vitro. |
El cultivo se incuba bajo condiciones de luz, temperatura y humedad controladas, que junto con las fisicoquímicas y nutricionales conducen el desarrollo del explante hacia la formación de una masa celular amorfa denominada callo, o hacia la diferenciación en un tejido organizado que producirá órganos o embriones. Los callos obtenidos mediante este procedimiento pueden subcultivarse para su mantenimiento y propagación o inducir su diferenciación para formar órganos (organogénesis), embriones (embriogénesis) o pasarse a un medio de cultivo líquido para obtener células y pequeños agregados en suspensión.
Los factores que se deben tener presentes para obtener una respuesta adecuada del explante incluyen:
- Posición de la planta donadora
- Edad ontogenética (juvenilidad/madurez) de la planta
- Estado fisiológico de la misma.
Aunado, se deberá considerar la especie con la que se está trabajando y los objetivos que se buscan.
La reproducción asexual de plantas por cultivo de tejidos es posible gracias a que, en general, las células de un individuo vegetal poseen la capacidad necesaria para permitir el crecimiento y el desarrollo de un nuevo individuo, sin que medie ningún tipo de fusión de células sexuales o gametos.
Así, las células vegetales crecidas en condiciones asépticas sobre medios de cultivo adicionados con hormonas vegetales, pueden dividirse dando dos tipos de respuesta:
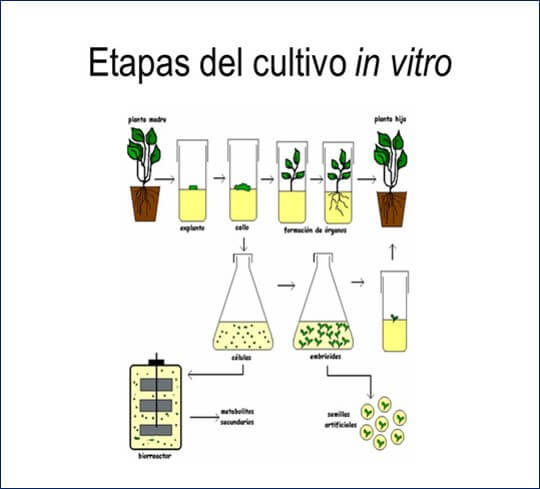
|
Figura 2. Etapas de cultivo in vitro. Cultivo de células y órganos vegetales. Fuente: http://slideplayer.es/slide/2273495/ |
- Organogénesis / embriogénesis indirecta. Una desdiferenciación celular acompañada de crecimiento tumoral, que da lugar a una masa de células indiferenciadas denominada callo, la cual bajo las condiciones adecuadas es capaz de generar órganos o embriones somáticos (llamados así porque son estructuras similares a un embrión pero que no se originaron por unión de gametos).
- Organogénesis / embriogénesis directa. Una respuesta morfogenética por la cual se forman directamente órganos (organogénesis) o embriones (embriones somáticos).
La formulación del medio cambia según se quiera obtener un tejido desdiferenciado (callo), yemas y raíces, u obtener embriones somáticos para producir semillas artificiales. El éxito en la propagación de una planta dependerá de lograr la expresión de la potencialidad celular total, es decir, que algunas células recuperen su condición meristemática. Para lograrlo, debe inducirse primero la desdiferenciación y luego la rediferenciación celular. Un proceso de este carácter sucede durante la formación de las raíces adventicias en el enraizamiento de estacas, la formación de yemas adventicias. Entre los factores más importantes a tener en cuenta para lograr la respuesta morfogenética deseada, es la composición del medio de cultivo.
En todo intento de propagación vegetal, ya sea in vitro o in vivo, el carácter del proceso de diferenciación depende del genoma de la especie, y está regulado por el balance hormonal propio y por el estado fisiológico del órgano, tejido o célula puesta en cultivo. Sin embargo, también se sabe que ese balance puede ser modificado por el agregado de compuestos que imiten la acción de las hormonas vegetales. Esos compuestos, denominados reguladores del crecimiento, son los que se emplean en los medios de cultivo para conseguir la micropropagación de una planta.
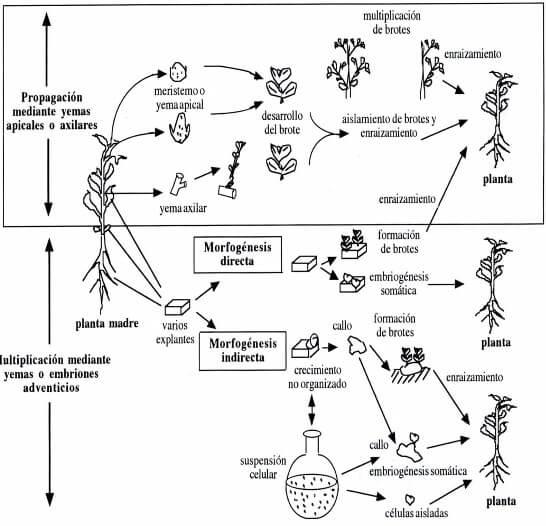
|
Figura 3. Imagen 3. Técnicas in vitro en el cultivo de tejidos. Fuente: Lindsey & Jones, 1989. Plant Biotechnology in Agriculture p 59. |
Las principales aplicaciones de la técnica de cultivo de células, tejidos y órganos vegetales son en los campos de micropropagación, obtención de plantas libres de patógenos, preservación de germoplasma, mejoramiento genético, biosíntesis de metabolitos e investigación básica en áreas como la genética, fisiología y bioquímica (Fowler 1987, Carpita y McCann, 2000). La clonación debe utilizarse para evitar el empobracimiento genético de las especies, teniendo el cuidado de introducir nuevos clones, variedades e híbridos de manera permanente.
Ventajas de la técnica de CCTV
- Producción de gran número de plantas. Obtención de plantas en cualquier época del año
- Almacenamiento de plantas en poco espacio
- Producción de plantas libres de contaminación, enfermedades y plagas
- Herramienta para el fitomejoramiento: plantas mejoradas
- Propagación de especies de difícil propagación por otros métodos, o en vías de extinción
- Clonación de individuos "élite", son desempeño agronómico destacado
- Obtención de plantas libres de virus
- Producción de semillas sintéticas
- Conservación de germoplasma: material de un conjunto de individuos que representa la variabilidad genética de una población vegetal
- Obtención de metabolitos secundarios
- Producción de nuevos híbridos
- Mejora genética de plantas
- Germinación de semillas
- Producción de haploides y dobles haploides
- Estudios fisiológicos diversos
Desventajas de la técnica in vitro
- No todas las especies son viables de propagar in vitro; algunas son recalcitrantes
- Cada especie requiere de métodos específicos
- La estandarización de protocolos resulta costosa
Casos de éxito
Esta técnica ha tenido gran éxito en especies como el Agave tequilana Weber var. "Azul", donde la industria tequilera requiere de sembrar varios millones de plantas cada año y enfrenta diversos problemas propios del agave (tiempos de cosecha largos, baja variabilidad de material genético, etc.). Otro caso, es en el cultivo de papaya, donde la diversidad sexual de la planta produce plantas que darán frutos no comerciales. En ambos casos, el Dr. Cuauhtémoc Navarro, Director de Operaciones de la compañía NSIP (antes Agromod in vitro), ha trabajado en su propagación por estas técnicas. Se trata de la infraestructura más grande en América Latina para la micropropagación y mejoramiento vegetal, entregando anualmente millones de plantas de agave, plátano, café, papaya y ornamentales libres de enfermedades; con lo cual se demuestra que es una técnica totalmente viable comercial y técnicamente hablando. En el Sexto Congreso de Nutrición y Fisiología Vegetal Aplicadas de Intagri, el Dr. Cuauhtémoc Navarro hablará de su experiencia y aprendizaje con estas técnicas de propagación.

Fuentes consultadas
Albarrán, J.; Fuenmayor, F.; Fuchs, M. 2003. Propagación Clonal Rápida de Variedades Comerciales de Yuca Mediante Técnicas Biotecnológicas. Ceniap. Venezuela.
Bermejo, C.M.E. 2010. Cultivo in vitro de Jatropha curcas para la Obtención de Curcina. Instituto Politécnico Nacional. México.
Bouharmont, J. 1994. Application of Somaclonal Variation and in vitro Selection to Plant Improvement. Acta Hortic. 355: 213-331.
Calva, C.G.;Pérez, V. J. 2005. Cultivo de Células y Tejidos Vegetales: Fuente de Alimentos para el Futuro. Revista Digital Universitaria. México.
Ferl, R.; Paul, A. L. 2000. Genome Organization and Expression. En: Buchanan B., Gruissem W., Jones R. (eds.) Biochemistry and Molecular Biology of Plants. USA: American Society of Plant Physiologists, pp. 312-357.
Fowler, M. W. 1987. Products From Plant Cells. En: Bu'lock J., Kristiansen B. (Eds.) Basic Biotechnology. Academic Press, M., London, England. pp. 525-544.
Höxtermann, E. 1997. Cellular “Elementary Organisms” in vitro. The Early Vision of Gottlieb Habertlandt and its Realization. 100: 716-728.
Kieran, P.; MacLoughlin, P.; Malone, D. 1997. Plant Cell Suspension Cultures: Some Engineering Considerations. Journal of Biotechnology. 59: 39-52.
Predieri, S. 2001. Mutation Induction and Tissue Culture in Improving Fruits. Plant Cell Tissue Organ Cult. 64: 185-210.





me podrian mencionar algunos ejemplos de plantas que se puede realizar de manera invitro
Gracias por el comentario. Como lo dice el artículo, esta técnica es utilizada para cultivos como agave, papaya, plátano, café u ornamentales.
Saludos.
sería factible cultivar in vitro pera a partir de la pìel del fruto. Saludos
Es factible siempre y cuando se realice adecuadamente el procedimiento correspondiente, aunque lo más utilizado son las yemas apicales.
Saludos.
Muy interesante.la diversidad de temas tratados.Cracias.
Gracias por su comentario. Esperamos que continué visitando nuestros artículos que tenemos publicados en nuestra página.
Saludos.
Disculpen su documento es muy bueno pero queria ver la posibilidad si me podian dar datos para citar en formato APA
gracias
Atendiendo tu solicitud, te dejamos la forma correcta de citar el artículo:
Rivas, C. G. ,2016. Cultivo In Vitro de Células y Tejido Vegetal. Serie Nutrición Vegetal. Núm. 59. Artículos Técnicos de INTAGRI. México. 5 p.
Saludos.
Buenas días.
Soy un alumno de Investigación del Instituto IES San Isidoro, España.
Estoy trabajando en un proyecto de investigación sobre el cultivo in vitro de tejidos vegetales, y me gustaría obtener algunas definiciones de su página, siempre nombrando a la página y a sus autores. Por tanto, quería preguntarle si usted me podría autorizar el uso de la información aquí brindada.
Gracias.
Buenas tardes.
Por supuesto, usted puede emplear la información que desee, pero tal como lo menciona debe citar adecuadamente la fuente.
La cita correcta del artículo es la siguiente:
Rivas, C. G. ,2016. Cultivo In Vitro de Células y Tejido Vegetal. Serie Nutrición Vegetal. Núm. 59. Artículos Técnicos de INTAGRI. México. 5 p.
Cualquier duda estamos a sus órdenes.
Saludos.
Buenas Tardes!! Utilice esta informacion para un trabajo y quisiera citarlos correctamente. Me podrian decir quien es el autor y la fecha en que publicaron el articulo. Gracias y perdone la molestia.
La cita correcta del artículo es la siguiente: Rivas, C. G. ,2016. Cultivo In Vitro de Células y Tejido Vegetal. Serie Nutrición Vegetal. Núm. 59. Artículos Técnicos de INTAGRI. México. 5 p.