Autor: Alvaro Segura Monge
Profesor de la Universidad de Costa Rica
La Sigatoka negra (SN) también conocida como BLSD, es causada por el hongo ascomiceto Pseudocercospora fijiensis M. Morelet-Deighton, anteriormente denominado como Mycosphaerella fijiensis M. Morelet (Arango-Isaza et al., 2016). Este hongo ha sido durante mucho tiempo una limitación importante para la producción de banano y plátano induciendo una defoliación severa y afectando el rendimiento en la mayoría de las zonas tropicales y tropicales donde se cultivan bananas y plátanos (Carlier et al., 2000). Es una de las amenazas biológicas más graves para la producción de banano, para la seguridad alimentaria y la exportación a nivel global (Churchill, 2011).
El objetivo del presente trabajo es hacer una revisión de los procesos que utilizan las plantas de banano para responder a la invasión de los tejidos foliares por parte de Pseudocercospora fijiensis, y su estrategia de producción de fitotoxinas.
Producción de especies reactivas de oxígeno (ROS) en respuesta a la invasión por Pseudocercospora fijiensis:
Una vez que ocurre la infección por un patógeno (por acción de fitotoxinas), se activan las defensas de las plantas. La primera reacción es la respuesta hipersensitiva (HR), la cual causa apoptosis (programación de la muerte de las células) alrededor de las zonas infectadas, a efecto de limitar la diseminación de la infección. Aunque la HR es uno de los factores más importantes para limitar el crecimiento de patógenos biotróficos (necesitan que el huésped esté vivo, parásitos obligados), no parece proteger a las plantas contra patógenos necrotróficos (se alimentan de tejido muerto, parásitos facultativos) y hemibiotróficos (pueden vivir en tejidos vivos y muertos, Pseudocercospora fijiensis), que pueden aprovechar la programación de la muerte de las células inducida en las células huésped, para facilitar su invasión y completar su ciclo de propagación (Oliver y Solomon, 2004, Van-Kan, 2006).
Los principales agentes que causan apoptosis, son las especies reactivas de oxígeno (ROS), tales como los radicales aniónicos superóxido, los radicales OH-, y el peróxido de hidrógeno (H₂O₂). Estos radicales libres afectan a las membranas celulares, provocando un daño de sus propiedades selectivas y con ello la pérdida de electrolitos que aceleran la muerte de las células. (Anthony et al., 2017).Como reacción a la producción de especies reactivas de oxígeno, las plantas producen enzimas barredoras de estas (ERO-scavengers), que neutralizan a los radicales libres y con ello mantienen la homeostasis del sistema. También se producen compuestos antioxidantes, los que actúan mitigando y reparando los daños causados por las ERO. Dentro de estos antioxidantes se incluyen los flavonoides, polifenoles y otros más.
Por tanto, la producción de estos antioxidantes es un reflejo de la actividad de defensa de las plantas y a la inducción de la HR, en este caso debido al ataque de un patógeno (Anthony et al., 2017).
Hay varias reacciones bioquímicas que ocurren después que plantas de banano resistentes son infectadas con Pseudocercospora spp (Dhakshinamoorthy et al., 2014). Estos incluyen el fortalecimiento de barreras físicas, como la lignificación, la respuesta hipersensible y la producción de compuestos como fitoanticipinas, fenoles, fenilfenanalenonas, peroxidasas, fenilalanina amoniaco-liasa, b-1,3-glucanasa y peróxido de hidrógeno (Hoss et al., 2000; Otalvaro et al., 2007; Cruz-Cruz et al., 2010; Sánchez et al., 2010; Cavalcante et al., 2011; Torres et al., 2012; Sánchez-García et al., 2013; Hidalgo et al., 2016). Los patógenos de las plantas secretan una amplia gama de moléculas pequeñas (microARN, metabolitos y toxinas) y proteínas denominadas efectores, las cuáles, dependiendo del estilo de vida del huésped, provocan respuestas de resistencia o susceptibilidad en cadena (Vleeshouwers & Oliver, 2014; Arango-Isaza et al., 2016).
La inmunidad activada por el efector es el resultado de la interacción entre los factores de virulencia del patógeno y sus genes de resistencia afines en el huésped (Vleeshouwers y Oliver, 2014).
El Hadrami et al., (2005) evaluaron la respuesta diferencial de dos cultivares (cv. Grande Naine susceptible a BLSD y juglone y cv. ¨Fougamou¨ parcialmente resistente a la ¨Sigatoka negra¨ y altamente tolerante a juglone) respecto a la producción de ROS, como reacción a la aplicación de juglone. Los autores demostraron que la producción de ROS es la diferencia clave entre ambos cultivares, observándose (Figura 1) una liberación temprana de las ROS (radical libre de O₂ y H₂O₂) y una rápida estimulación de un sistema antioxidante (superóxido dismutasas, catalasas y peroxidasas) en el cv. ¨Fougamou¨ en comparación con el cv. ¨Grande Naine¨ (Figura 2). En el caso de ¨Fougamou¨ la concentración es mayor y su aumento es más rápido que en Grande Naine.
En respuesta al juglone, se producen ROS, que son altamente reactivas y dañan las membranas celulares, los lípidos, proteínas, pigmentos y ácidos nucleicos, resultando en una dramática reducción y deterioro de sus funciones, causando la muerte de los tejidos. Por otro lado, en respuesta a la producción de ROS, se activa un mecanismo de defensa, a través de la producción de sustancias antioxidantes que neutralizan el efecto dañino producido por las ROS.
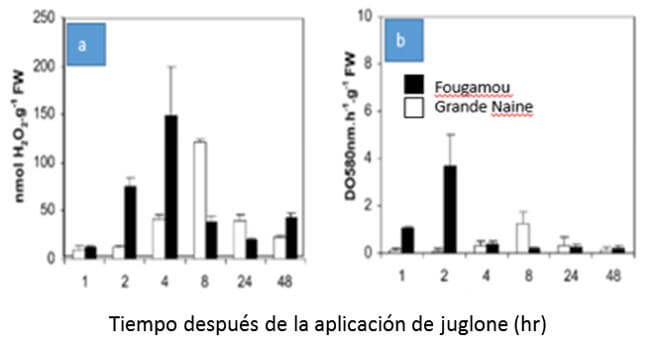
|
Figura 1. Contenido de especies reactivas de oxígeno: H2O2 (a) y O2 (b) en hojas de “Grande Naine” (susceptibles a Sigatoka negra y a juglone) y Fougamou (Parcialmente resistente a Sigatoka negra y altamente tolerante a juglone), después de varias horas de exposición a juglone. |
En el caso de ¨Fougamou¨ la concentración de antioxidantes es mayor que en ¨Grande Naine¨. Cuanto mayor es el estrés oxidativo, mayor es la producción de H₂O₂ (ROS) y también de las sustancias antioxidantes que neutralizan la acción destructiva de las ROS.
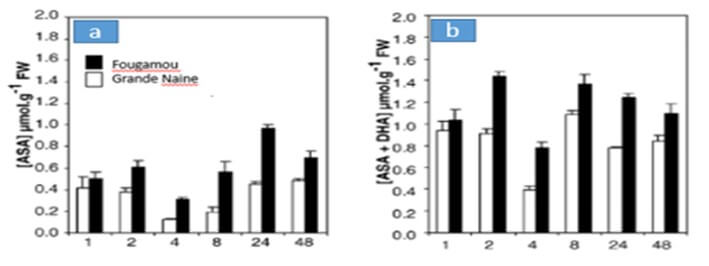
|
Figura 2. Contenido de antioxidantes: Ascorbato oxidado (a), Ascorbato oxidado y reducido (b) y en hojas de “Grande Naine” (susceptible a Sigatoka negra y a juglone) y “Fougamou” (Parcialmente resistente a Sigatoka negra y altamente tolerante a juglone), después de varios periodos expuestos a juglone. Fuente: El Hadrami, D. et al., 2005. |
En la Figura 3 se presenta un diagrama donde se sumarizan, las reacciones que eventualmente se involucran después de la invasión de Pseudocercospora fijiensis a los tejidos foliares de una planta de banano susceptible a este patógeno.
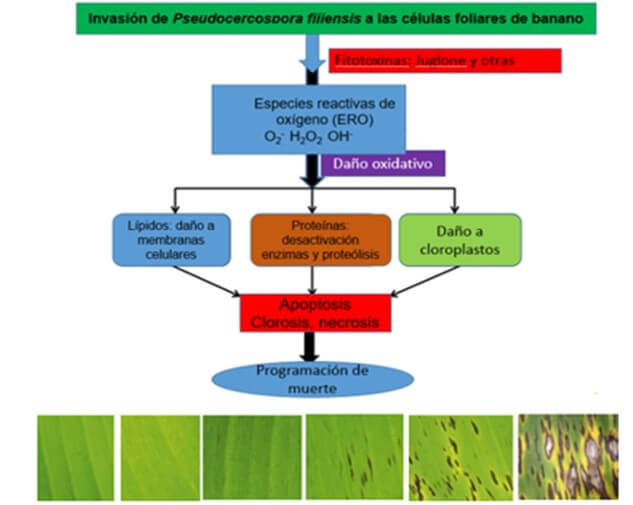
|
Figura 3. Diagrama de la secuencia de reacciones que ocurren después de la invasión de Pseudocercospora fijiensis a las celulas foliares de la planta de banano. Fuente: Adaptado de Rashmi, A. et al., 2015 |
Bosogoro et al., (2004 a) y Bosogoro et al., (2004 b), observaron una alta capacidad oxidante del juglone sobre el ácido ascórbico en cloroplastos aislados de banano (¨Grande Naine¨), en relación al testigo en ausencia de juglone (Figura 4). La estricta dependencia de la luz de los síntomas inducidos por extractos hidrofóbicos obtenidos de P. fijiensis y del juglone, sobre la inhibición en la transferencia de electrones en cloroplastos (Reacción de Hill), y el hecho de que los cloroplastos constituyen uno de los sitios de producción de especies de oxígeno activo en las plantas, sugieren que la toxicidad de juglone podría ser inducida por eventos oxidativos relacionados con alteraciones en la capacidad de desintoxicar ROS.
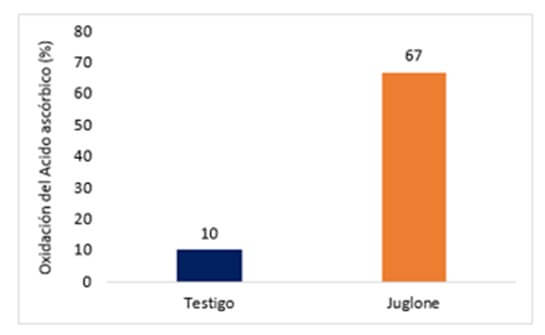
|
Figura 4. Efecto de la incubación de juglone (60 ppm) sobre la oxidación del ácido ascórbico (antioxidante) en cloroplastos aislados de banano incubados en presencia de ácido ascórbico (0.5mM) en relación al testigo, incubado en una solución de ácido ascórbico en ausencia de juglone. Datos obtenidos después de una hora de incubación. Fuente: Busogoro, J. P. et al. 2004 b. |
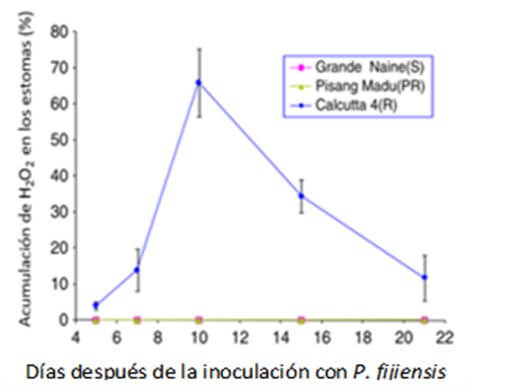
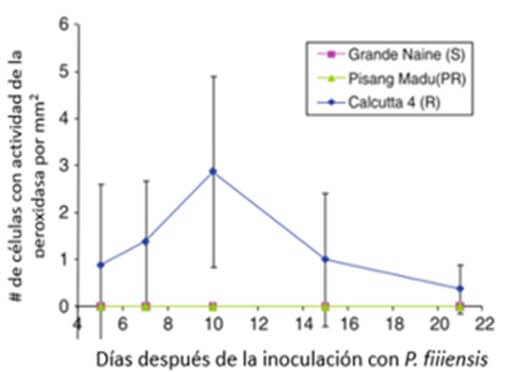
Rodriguez et al., (2020) determinaron que la activación temprana de la biosíntesis de ácido jasmónico (JA) y el etileno (ET) forman parte de la respuesta del fenotipo resistente ¨Calcutta 4¨ a la inoculación con P. fijiensis. En contraste, en bananos susceptibles cv. ¨Williams¨, la activación de JA y las respuestas relacionadas con la defensa de ET son débiles, tardías o no están presentes, en esta variedad, indicando que la regulación de la señal hacia JA ocurre por un mecanismo diferente al de ¨Calcutta 4”. Cavalcante et al., (2011) determinaron una acumulación H2O2 (Figura 5) y peroxidasa (Figura 6) a nivel foliar en respuesta a la inoculación de Pseudocercospora fijiensis en plantas de ¨Calcutta 4¨ (Musa AA, subespecie Burmanica, resistente), pero no en plantas de ¨Grande Naine¨ (susceptible, Musa AAA) ni en Pisang Madu (parcialmente resistente). Esto indica un posible papel de la enzima peroxidasa en los mecanismos de defensa contra P. fijiensis en plantas de banano.
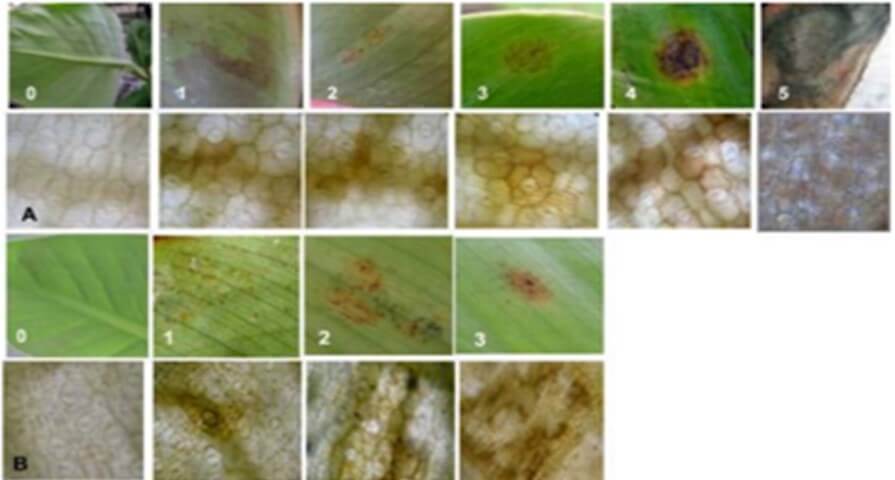
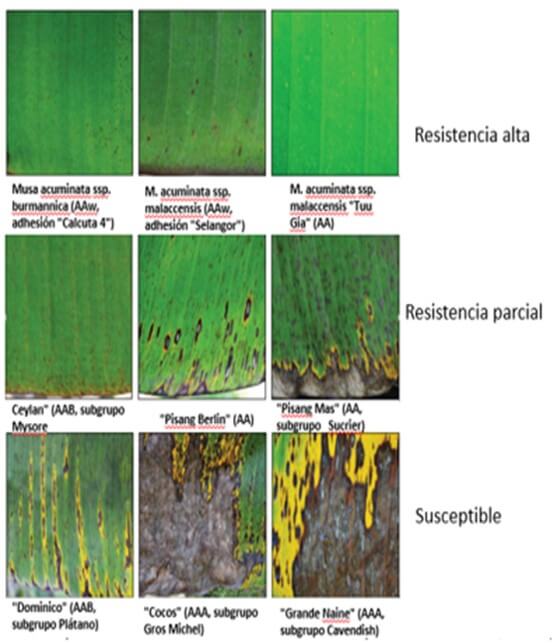
Por su parte Sánchez, C. et al. (2010), Hicieron evaluaciones histológicas del acúmulo de H₂O₂ en hojas de “Grande Naine” y “Calcutta 4” inoculadas con P. fijiensis, pudiendo detectar que en el cultivar susceptible, la presencia de peróxido de hidrogeno se observó en los cinco estados de la lesión provocada por el hongo; sin embargo en el cultivar resistente, la deposición de peróxido de hidrogeno solamente se observó en los primeros tres estados, que es justamente hasta donde se desarrolló el patógeno (Figura 7). De acuerdo con Cavalcante, et al., (2011), la producción de peroxidasa en “Calcutta 4” es probablemente la razón por la cual, en este material hay una limitación en el avance de la enfermedad, al punto que el patógeno no llega a la etapa de esporulación. Port su parte Abadie, C. et al., (2019) muestran la reacción diferencial de varios cultivares de Musa spp en respuesta a la infección de P.fijiensis bajo alta presión de inóculo, donde se observan materiales susceptibles, parcialmente resistentes y resistentes (Figura 8).
|
Figura 5. Acumulación de peróxido de hidrogeno en los estomas de tres cultivares de banano (Grande Naine: susceptible, Pisang Madu: parcialmente resistente y Calcuta 4: resistente) después de la inoculación con cultivos monospóricos de Pseudocercospora fijiensis. Los tejidos foliares fueron teñidos con 3,3’-diaminobenzidine (DAB). Fuente Cavalcante, J. et al. 2011. |
|
Figura 6. La actividad de peroxidasa en los estomas de banano de tres cultivares (Grande Naine, Pisang Madu: parcialmente resistente y Calcuta 4: resistente) después de la inoculación con cultivos monospóricos de Pseudocercospora fijiensis. Los tejidos foliares fueron teñidos con 3, 3’-diaminovenzine (DAB). Fuente: Cavalcante, J. et al., 2011 |
|
Figura 7. Acumulación de peróxido de hidrogeno (H2O2) en hojas de plantas inoculadas con P. fijiensis. A. Plantas susceptibles (“Grande Naine”) y b. Plantas resistentes (“Calcuta 4”). 0: Plantas sin inocular. 1: Estado. 2 Estado 2. 3: Estado 3. 4: Estado 4. 5. Estado 5 de los síntomas provocados por el patógeno (400x). Nótese que en “Calcutta 4” no hay evolución de las lesiones más allá del estado 3, por lo que el hongo no llega a esporular. Fuente: Sánchez, C. et al. 2010 |
Puede darse el caso inverso, es decir, que las plantas de banano resistentes a patógenos, activen mecanismos de defensa hacia el patógeno, a través de la producción de sustancias tóxicas a P.fijienses. Las fenilfenalenonas, son un grupo de compuestos aromáticos policíclicos que se encuentran en las familias de plantas Haemodoraceae, Pontederiaceae, Strelitziaceae y Musaceae. (Munde et al., 2013, citados por Hidalgo et al., 2016). Estas sustancias actúan como fitoalexinas en el género Musa spp, y se inducen en las hojas o en las raíces de las plantas que se ven afectados por factores bióticos o abióticos. Además, sus fuertes propiedades antimicrobianas y nematicidas, los han hecho valiosos para explicar la base química de la resistencia de algunos cultivares de Musa spp, en respuesta al ataque de plagas (Hölscher et al., (2014), citados por Hidalgo et al., 2016).
Hölscher et al., (2015), citados por Hidalgo et al., (2016), identificaron algunas fenilfenalenonas a nivel celular en los estomas de hojas de Musa spp., posteriormente Hidalgo et al., (2016) obtuvieron evidencias del primer caso de desintoxicación metabólica de fenilfenalenonas fungitóxicas por parte de algunos aislamientos de P.fijiensis, como estrategia para evadir la defensa química de plantas de Musa spp, resistentes al ataque del patógeno. Beltrán-García et al., (2014) encontraron que la melanina, un pigmento constituido por un grupo heterogéneo de sustancias poliméricas amorfas, fue sinterizada por Pseudocercospora fijiensis, actuando como un factor de virulencia a través de la fotogeneración de una ROS (oxígeno molecular singlete) que causa muerte celular en los tejidos de banano (grupo Cavebdish, AAA). Los autores señalan que hacen falta más investigaciones para evaluar completamente las contribuciones de las ROS inducidas por la melanina en la patogénesis de P.fijiensis.
Comentarios finales:
- La planta de banano en respuesta a la producción de fitotoxinas, activa un mecanismo de respuesta hipersensible (RH), que permite la producción de especies reactivas de oxígeno (ROS), que dañan membranas celulares, proteínas, ácidos nucleicos; todo lo cual conduce, a una ¨disposición fisiológica¨ que conduce a la muerte de las células (apoptosis). Esta muerte celular puede limitar la perpetuidad de un patógeno biotrófico, pero en caso de P.fijiensis, no es una estrategia real de contención, toda vez que el hongo es hemibiotrófico.
- A través de la respuesta al hongo por parte de cultivares resistentes, se ha podido comprobar la presencia de genes y proteínas, que les permite a estas plantas, responder eficientemente a la producción de fitotoxinas emitidas por el hongo. De esta manera sintetizan rápidamente ROS, y de igual manera, sustancias antioxidantes que bloquean la acción dañina de las primeras, manteniendo a las células de la planta activas si afectar su capacidad fotosintética.
|
Figura 8. Ejemplos de los tres tipos de reacción de Musa a Pseudocercospora fijiensis propuestos por Fouré, et al. (1990) y Fouré (1992, 1994). Todas las fotografías fueron tomadas en el mismo lugar en La Rita, Pococí, Costa Rica el mismo día con todas las plantas bajo alta presión de inóculo (fotos: M, Sánchez. C. Carr, F. Alfaro y M. Guzmán, CORBANA) Fuente: Abadie, C. et al. 2019 |
Agradecimiento: Al Dr. Douglas Marín PhD., por la revisión del manuscrito y por sus acertadas recomendaciones.
Cita correcta de este artículo
Segura, M. A. 2020. Procesos Fisiológicos Involucrados en el Daño Producido por Pseudocercospora fijiensis en las Plantas de Banano (Musa spp): Producción de Especies Reactivas (parte 2). Serie Frutales, Núm. 72. Artículos técnicos de INTAGRI. México. 9 p.
Literatura consultada
- Anthony, K.K.; George, D.S.; Kair, H.; Singh, B.; Fung, S.M. 2017. Reactive Oxygen Species Activity and Antioxidant Properties of Fusarium Infected Bananas. 165: 213-222. DOI: https://doi.org/10.1111/jph.12552.
- Abadie, C. et al. 2019. Evaluating Musa accessions for reaction to black leaf streak. In: Jones, D.R., editor. Diseases of Banana, Abaca´ and Enset. Wallingford, Oxon OX10 8DE UK: CABI Publishing. 74- 88 pp.
- Arango-Isaza I, R. E.; Diaz-Trujillo, C. T. C.; Dhillon, B.; Aerts, A.; Carlier, J.; Cane, C.F.; et al. 2016. Combating a Globall Threat to a Clonal Crop: Banana Black Sigatoka Pathogen Pseudocercospora fijiensis (Synonym Myscosphaerella fijiensis) Genomes Reveal Clues for Disease Control. Plos Genet 12(8): e1005876. doi: 10.1371/journal.pgen.1005876 PMID: 27512984.
- Beltrán-García, MJ; Prado, FM; Oliveira, MS; Ortiz-Mendoza, D; Scalfo, AC; Pessoa, A; Medeiros, MHG; White, JF; Di Mascio, P. 2014. Singlet molecular oxygen generation by light-activated DHN-melanin of the fungal pathogen Mycosphaerella fijiensis in black sigatoka disease of bananas. PLoS ONE 9(3). DOI: https://doi.org/10.1371/journal.pone.0091616.
- Busogoro, J.P.; Etame´, J.J.; Harelimana, G.; Lognay, G.; Messiaen, J.; Lepoire, P.; Van Cutsem, P. 2004 a. Experimental Evidence for the Action of M. fijiensis Toxins on Banana Photosynthetic Apparatus. In: Mohan, J.S., Swennen, R. (eds) Banana improvement: Cellular, Molecular Biology, and Induced Mutations. Science Publishers, Enfield. 161–170 p.
- Busogoro, J.P.; Etame´, J.J.; Lognay, G., Messiaen, J.; Van Cutsem, P.; Lepoire, P. 2004 b. Analysis of the Mechanisms of Action of Mycosphaerella fijiensis Toxins During the Development of Black Leaf Streak Disease. In: Mohan, J.S., Swennen, R. (eds) Banana improvement: Cellular, Molecular Biology, and Induced muta- tionstions. Science Publishers, Enfield. 181 p.
- Carlier, J., Foure´, E., Gauhl, F., Jones, D.R., Lepoivre, P., Mourichon, X. 2000. Fungal diseases of the foliage: Sigatoka leaf spots. In: Jones DR, editor. Diseases of Banana, Abaca´ and Enset. Wallingford, Oxon OX10 8DE UK: CABI Publishing.
- Churchill, A.C.L. 2011. Mycosphaerella fijiensis, the black leaf streak pathogen of banana: Progress towards understanding pathogen biology and detection, disease development, and the challenges of control. Molecular Plant Pathology 12(4):307–328. DOI: https://doi.org/10.1111/j.1364-3703.2010.00672.x.
- Cruz-Cruz, C.A. 2011. Physiological Effects of the Hydrophilic Phytotoxins Produced by Mycosphaerella fijiensis, the causal agent of black. J Gen Plant Pathol. 77:93–100.
- El Hadrami, A; Kone, D.; Lepoivre, P. 2005. Effect of Juglone on Active Oxygen Species and Antioxidant Enzymes in Susceptible and Partially Resistant Banana Cultivars to Black Leaf Streak Disease. European Journal of Plant Pathology 113:241–254. DOI: https://doi.org/10.1007/s10658-005-8675-y.
- Dhakshinamoorthy, S.; Mariama, K.; Elsen, A.; Waele, D.D. 2014. Phenols and Lignin are Involved in the Defence Response of Banana (Musa) Plants to Radopholus Similis Infection. Nematology. 16, 565–76.
- Hidalgo, W.; Chandran, J.N.; Menezes, R.C.; Otálvaro, F.; Schneider, B. 2016. Phenylphenalenones Protect Banana Plants from Infection by Mycosphaerella fijiensis and are Deactivated by Metabolic Conversion. Plant Cell and Environment. 39(3):492–513. DOI: https://doi.org/10.1111/pce.12630.
- Hoss, R.; Helbig, J.; Bochow, H. 2000. Function of Host and Fungal Metabolites in Resistance Response of Banana and Plantain in the Black Sigatoka Disease Pathosystem (Musa spp.–Mycosphaerella fijiensis). Journal Phytopathology.148:387-394.
- Oliver, R.P.; Solomon. P.S. 2004. Does the Oxidative Stress Used by Plants for Defense Provide a Source of Nutrients for Pathogenic Fungi. Trends Plant Science. 9:472–4.
- Otalvaro, F.E.; Juliana, N.; Luz, V. et al. 2007. Phenalenone-type Compounds from Musa Acuminata var. ‘Yangambi km 5’ (AAA) and their Activity against Mycosphaerella fijiensis. Journal of Natural Products. 70: 887–90.
- Rashmi, A.; Kalpna, B.; Harsh, N. 2015. Temperature Stress and Redox Homeostasis in Agricultural Crops. Frontiers in Environmental Science. 3: 1-24.
- Torres, J.M.; Calderón, H.; Arango, E.R.; Morales, J.G.; Arango R. 2012. Differential Induction of Pathogenesis-related Proteins in Banana in Response to Mycosphaerella fijiensis Infection. European Journal of Plant Pathology. 133: 887–98.
- Sanchez, G. C.; Alvarado, C.Y.; Acosta, S.M. et al. 2013. Quantification of Phenols in Lesions caused by Mycosphaerella fijiensis Morelet in ‘Cavendish Naine’. Revista de Protección Vegetal. 28: 149–52.
- Van, K. J. A. L. 2006. Licensed to Kill: the Lifestyle of a Necrotrophic Plant Pathogen. Trends Plant Science. 11: 247–253.




Aún no hay comentarios sobre el artículo