Autor: Alvaro Segura Monge
Profesor de la Universidad de Costa Rica
La Sigatoka negra (SN) también conocida como BLSD, es causada por el hongo ascomiceto Pseudocercospora fijiensis M. Morelet-Deighton, anteriormente denominado como Mycosphaerella fijiensis M. Morelet (Arango-Isaza et al., 2016). Este hongo ha sido durante mucho tiempo una limitación importante para la producción de banano y plátano induciendo una defoliación severa y afectando el rendimiento en la mayoría de las zonas tropicales y tropicales donde se cultivan bananas y plátanos (Carlier et al., 2000). Es una de las amenazas biológicas más graves para la producción de banano, para la seguridad alimentaria y la exportación a nivel global (Churchill, 2011).
La Sigatoka negra (Figura 1) es la enfermedad más dañina y costosa que afecta a la industria bananera a nivel mundial, debido a la naturaleza muy susceptible del único grupo de cultivares pertenecientes al subgrupo Cavendish (Musa AAA) utilizados en la exportación (de Lapeyre de Bellaire et al., 2010, Guillermet et al., 2018).
Según Guzmán et al., (2019) en cultivares de banano susceptibles a la Sigatoka negra, el impacto por la reducción del follaje, puede causar una reducción entre el 20% y 40% en el peso de la fruta y un daño del 100% en la calidad de exportación. El costo del control de la Sigatoka negra ha ido aumentando a lo largo de los años, debido a la rápida adquisición de resistencia del hongo a las principales moléculas fungicidas, lo que ha implicado un aumento en el número de pulverizaciones por año (Pérez-Vicente, 2012).
En Costa Rica, por las condiciones de clima altamente lluvioso en la Región Caribe, donde se concentra la producción bananera, se ha experimentado un aumento en el número de ciclos de pulverización de fungicidas a través del tiempo. Romero y Sutton (1997) mencionan que para el año 1995, el costo del control de la enfermedad en Costa Rica fue de US$ 49 millones, pero a hoy día con 43 mil hectáreas sembradas del cultivo, este monto puede alcanzar un valor cercano a los US$86 millones por año, sin considerar el costo que implica el manejo de la enfermedad a través de la deshoja sanitaria.
El impacto de la SN en la producción de banano para exportación, es atribuible a una disminución, tanto en el peso de la fruta (Figura 2) por efecto directo en la disminución de la tasa de fotosíntesis neta foliar, al reducirse el área foliar efectiva (Figura 3), así como también, en una drástica caída en la vida verde (Figura 4) de las frutas cosechadas (Rodríguez y Cayón, 2008, Chillet et al., 2009, Castelám et al., 2012, Chillet et al., 2014). Solo unos pocos países que cultivan banano comercialmente a nivel global están libres de esta enfermedad: India, Pakistán, Sudáfrica, Israel y Australia continental (Yonow et al., 2019).

|
Figura 1. Daño avanzado en las hojas del banano provocado por la “Sigatoka negra” (Pseudocercospora fijiensis). Fuente: Segura. 2020 |
El propósito de este trabajo es hacer una revisión de los procesos fisiológicos en la relación patógeno-planta de banano, que conducen a los daños provocados por P.fijiensis a nivel celular en la planta, los cuales tienen un impacto directo sobre la disminución en el peso y en la vida verde de la fruta y con ello en el rendimiento y en la rentabilidad del cultivo. Algunos de estos procesos tienen relación con los mecanismos de resistencia conocidos en relación al patógeno, los cuales son relevantes en búsqueda de fuentes de resistencia genética contra la enfermedad. Finalmente se mencionan algunos procesos que se presumen están involucrados en la reducción de la vida verde de la fruta en respuesta a la enfermedad.
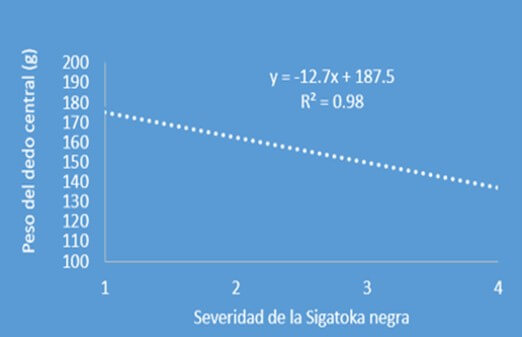
|
Figura 2. Efecto de la severidad de la Sigatoka negra sobre el peso del dedo central de la tercera mano. Los racimos fueron cosechados cuando acumularon 900 grados días. Fuente: Adaptado de Chillet, F.P. et al., 2014 |
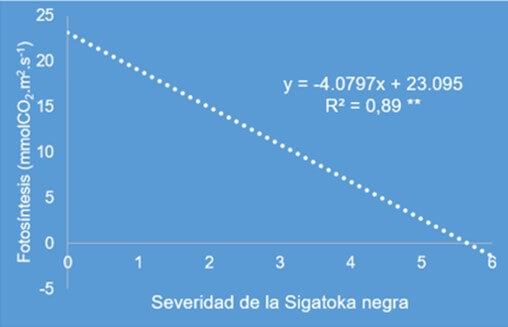
|
Figura 3. Efecto de la Sigatoka negra sobre la fotosíntesis neta foliar en banano. Grado de severidad 0: sin síntomas. 1: menos del 1% del área foliar. 2: 1-1.5% del área foliar. 3: 6-15% del área foliar. 4: 16-33% del área foliar. 5: 34-50% del área foliar. 6: más del 50% del área foliar afectada, respectivamente. Fuente: Rodriguez, P. y Cayón, G. 2008 |
Producción de la fitotoxinas por parte de Pseudocercospora fijiensis:
Los síntomas causados por Pseudocercospora fijiensis, aparecen como lesiones necróticas alargadas rodeadas de clorosis, lo que sugiriere una posible participación de compuestos fitotóxicos en el daño que causa este patógeno (Molina y Krausz, 1989, Upadhyay et al., 1989).
Pseudocercospora fijiensis produce una serie de metabolitos secundarios de bajo peso molecular (2, 4,8-trihidroxitetralona, 5-hidroxi-1,4-naftalenodiona (comúnmente llamado juglone), ácido 2-carboxi-3-hidroxicinámico, éster dimetílico del ácido 2-carboxi-3-metoxicinámico, ácido isoocracínico y 4-hidroxicitalona.), que son tóxicos a las plantas de banano (Molina y Krausz, 1989; Stierle et al., 1991; Harelimana et al., 1997; Hoss et al., 2000). Se sospecha que estos metabolitos contribuyen a la progresión de la enfermedad (Lepoivre, 2002). Las toxinas como el juglone, son fitotoxinas no específicas del huésped y pueden causar síntomas en banano, así como en muchas otras especies de plantas (Molina y Krausz, 1989).
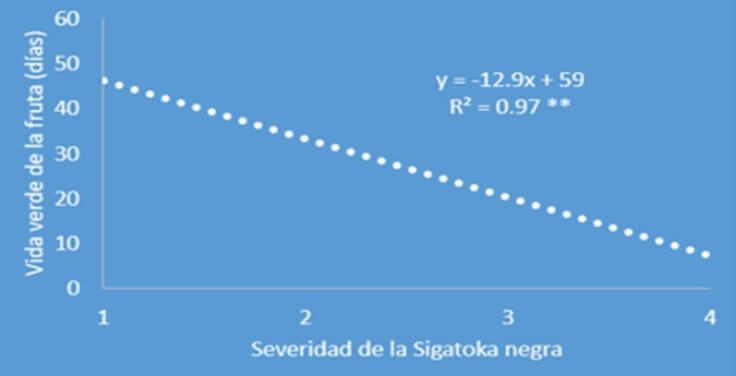
|
Figura 4. Efecto del incremento de la severidad de la Sigatoka negra sobre la duración de la vida verde del banano. Número de días que transcurrieron desde la cosecha hasta el inicio de la maduración a 13 °C y 85% de la humedad relativa. Los racimos fueron cosechados cuando acumularon 900 Grados día (suma de la temperatura promedio por encima de 14°C). Fuente: Chillet, M. et al., 2014 |
Las fitotoxinas son metabolitos secundarios producidos por los fitopatógenos, que provocan efectos adversos en el metabolismo de las plantas (Knoche y Duvick, 1987). Estas sustancias se han clasificado como fitotoxinas lipofílicas selectivas del huésped (HST) y fitotoxinas hidrofílicas no selectivas del huésped (no HST) según su función en la patogenicidad (Cruz-Cruz, 2011). Las HST son necesarias para que el patógeno colonice la planta y son tóxicas solo a los huéspedes del patógeno (Markham y Hille, 2001, Wolpert et al., 2002). Las no HST no son esenciales para la patogenicidad, pero contribuyen a la virulencia, y su toxicidad no es congruente con los patrones de resistencia y susceptibilidad en el huésped (Mitchell, 1984). El mecanismo de acción de las diferentes fitotoxinas lipofílicas producidas por M. fijiensis se ha estudiado muy poco; sin embargo, se ha informado de que su actividad depende de la luz, afectan al cloroplasto y alteran el gradiente electroquímico de protones a través de la membrana plasmática, aumentan la fuga de electrolitos e inducen una explosión oxidativa en Musa spp. (Busogoro et al., 2004 a, Busogoro et al., 2004 b; El Hadrami et al., 2005; Harelimana et al., 1997; Lepoivre et al., 2002).
Busogoro et. al., (2004 a) encontraron que la exposición de hojas de banano (Musa AAA, subgrupo Cavendish, Grande Naine) a varias concentraciones de fracciones lipofílicas de Pseudocercospora fijiensis, causaron una inhibición de la actividad fotosintética en los cloroplastos aislados del banano (Figura 5). Los autores utilizando técnicas de cromatografía de gases y espectrometría de masas (GC-MS), identificaron a juglone (5-hidroxi-1,4-naftoquinona) en la fracción más tóxica de los extractos de Pseudocercospora fijiensis.
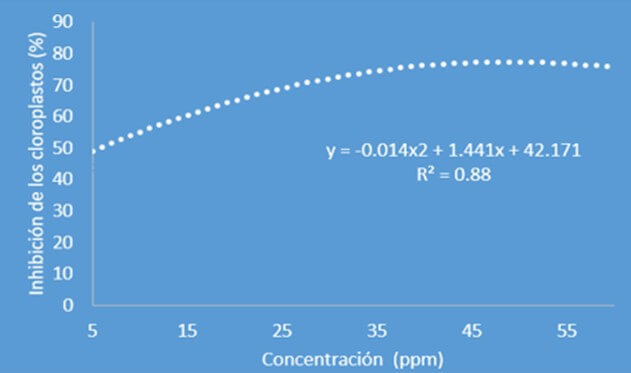
|
Figura 5. Efecto inhibidor de fracciones hidrosolubles semi-purificadas de aislamientos de Pseudocercospora fijiensis sobre la actividad fotosintética de cloroplastos aislados de banano (Musa AAA, Subgrupo Cavendish “Grande Naine”. Fuente: Adaptado de Busogoro, J.P. et al., 2004 a. |
De acuerdo con Busogoro et al., (2004 a), la inyección de juglone (fitotoxina lipofílicas selectiva, HS) en hojas de banano Grande Naine, susceptible a la Sigatoka negra y a juglone y Fougamou (Musa ABB), parcialmente resistente a la Sigatoka negra y resistente a juglone, indujo una mancha necrótica en el lugar de la inyección y disminuyó el índice de vitalidad relativa, calculado a partir de los datos de fluorescencia de la clorofila (Cuadro 1).
|
Cuadro. 1 Efecto de la inyección de varias dosis de Juglone a hojas de dos cultivares de banano (“Grande Naine”, susceptible a la Sigatoka negra y a Juglone y “Fougamou”, parcialmente resistente a la Sigatoka negra y resistente a Juglone). |
||||
|
Juglone (ppm) |
Índice de vitalidad relativa* (%) |
|||
|
Grande Naine |
Fougamou |
|||
|
|
Luz |
Oscuridad |
Luz |
Oscuridad |
|
0 |
100 |
100 |
100 |
100 |
|
25 |
63 |
97 |
84 |
90 |
|
50 |
54 |
87 |
77 |
82 |
|
100 |
49 |
72 |
67 |
79 |
|
250 |
41 |
62 |
49 |
73 |
|
500 |
26 |
49 |
28 |
73 |
*Obtenidos por cromatografía. ** Índice de vitalidad relativa es inversamente proporcional a la fluorescencia de la clorofila
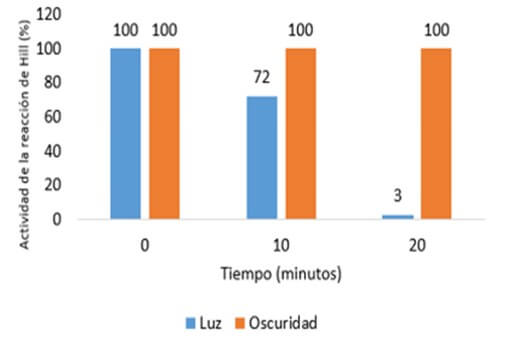
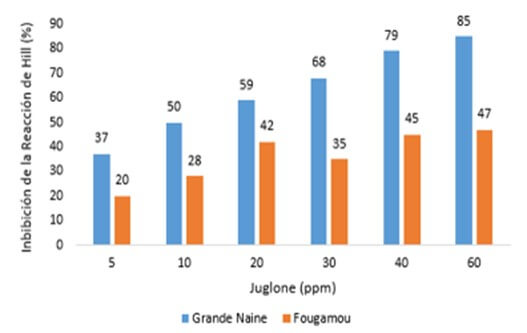
Según Busogoro et al., (2004 b), la actividad de juglone, dependió de la exposición a la luz, excepto en concentraciones muy altas (al menos 100 ppm) en las que la necrosis apareció tanto en la oscuridad como en la luz. Además, observaron que el cultivar Fougamou fue más resistente a juglone, que el cultivar Grande Naine. Según los autores, se desprende que el aparato fotosintético está involucrado en la actividad del juglone, lo cual fue ratificado al encontrar que la inoculación con varias dosis de esta toxina en cloroplastos aislados de una planta de Gande Naine, mostró una fuerte inhibición de la Reacción de Hill al exponerse a la luz, pero ningún efecto a la oscuridad (Figura 6). En forma paralela Busogoro et al., (2004 b), se encontraron (Figura 7) que la exposición a dosis crecientes de juglone produjo una fuerte inhibición de la Reacción de Hill en cloroplasto aislados e iluminados de Grande Naine, pero más reducida en cloroplastos obtenidos del cultivar Fougamou.
|
Figura 6. Efecto de la incubación con juglone (60 ppm) sobre la integridad de los cloroplastos aislados de banano (Reacción de Hill) a la luz y la oscuridad. Fuente: Busogoro, J.P. et al. 2004 b |
|
Figura 7. Efecto de la incubación con juglone, sobre la integridad de los cloroplastos aislados (Reacción de Hill) de los cultivares “Grande Naine” (susceptible a sigatoka negra y a juglone) y “Fougamou” (parcialmente resistente a Sigatoka negra y resistente a juglone). Fuente: Busogoro, J.P. et al, 2004 b. |
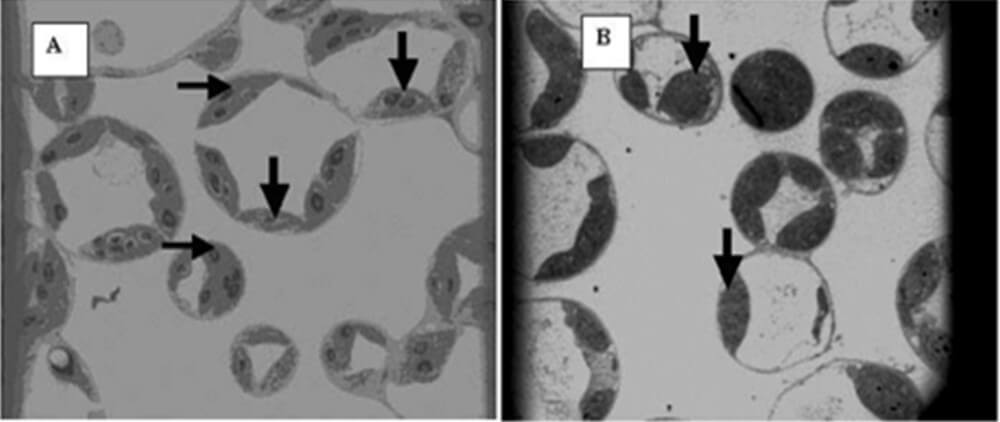
Busogoro et al., (2004 a) analizaron imágenes de microscopía electrónica de cloroplasto aislados de hojas inyectadas con (EaCE), metabolitos fúngicos extraídos con acetato de etilo de ascosporas de P.fijiensis (cuya fracción bioactiva semipurificada mostró propiedades globales similares a la de juglone en los cloroplastos de banano). Después de 6 h de incubación, la anomalía más llamativa fue la disminución del tamaño de los cloroplastos en el genotipo susceptible (Grande Naine) y una reducción de las dimensiones de los granos de almidón en los cloroplastos. Este tipo de modificaciones morfológicas no ocurrieron en los tejidos del cultivar parcialmente resistente (Fougamou).
Por lo tanto, se podría sospechar que los cloroplastos constituyen sitios de acción de las toxinas de P. fijiensis en los tejidos del banano (Figura 8)
|
Figura 8. Modificación morfológica de los cloroplastos de banano cv “Grande Naine”, después de seis horas de la infiltración de secciones de hojas con fracciones semi-puridicadas y juglone de Pseudocercospora fijiensies (aumento 550x). a: Hojas tratadas con una solución de metanol al 10% v/v, mostrando cloroplastos más grandes y granos de almidón mayores (flechas). b: Hojas tratadas con extractos de cultivos P. fijiensis, mostrando cloroplastos más pequeños y con granos de almidón de menos tamaño (flechas). Los cloroplastos son aparentemente los sitios de acción de toxinas de Pseudocercospora fijiensis en los tejidos de banano. Fuente: Busogoro, J.P. et al., 2004 b. |
Aunque su papel en las enfermedades de las plantas no está claro, en general se considera que el juglone no es necesario para la patogenicidad, pero probablemente funciona como un factor de agresividad ya que su producción da como resultado un aumento en la gravedad de la enfermedad (Molina y Krausz, 1988; Upadhyay et al., 1989; Lepoivre, 2002).
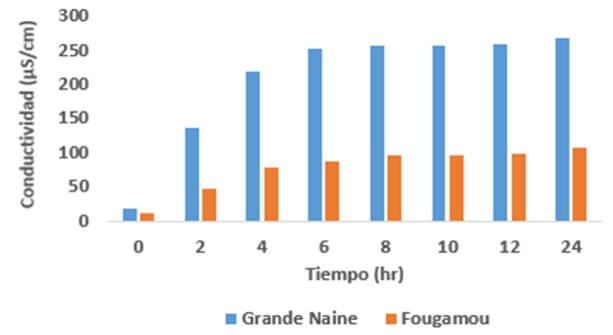
Cruz-Cruz (2011) encontró que P. fijiensis también producen fitotoxinas hidrófilicas no selectivas (no-HS), donde su fitotoxicidad no depende de la luz y actúan dañando las membrana plasmáticas. Estas fitotoxinas inducen la producción de especies reactivas de oxígeno, las cuales dañan las membranas celulares y con ello alterando la permeabilidad a través del daño oxidativo, provocando la pérdida de electrolitos celulares y la muerte de las células foliares del huésped, como parte de su mecanismo de acción. Este daño ocurrió en plantas de ¨Grande Naine¨, pero fue menor en el cultivar ¨Fougamou¨, parcialmente resistente al patógeno (Figura 9).
|
Figura 9. Conductividad de electrolitos para evaluar el daño de la membrana celular (fuga de electrolitos) después de un tratamiento de 24 h con el metabolito fitotóxico hidrofilico F5b en discos de hojas de plantas de banano de 4 meses cultivadas en macetas en un invernadero. Cultivares Grande Naine (susceptible) y Fougamou (parcialmente resistente). Fuente: Cruz-Cruz, C.A. 2011. |
Contrario a lo indicado por Bosogoro et al., (2004 a) y Bosogoro et al., (2004 b), los resultados indicados por Cruz-Cruz (2011) muestran que la toxicidad de las fitotoxinas, no dependen de la presencia de luz. Sobre este tema, Carlier et al.,(2019) señalan que a nivel de campo, han observado que los síntomas de la enfermedad son más débiles en las plantas de banano y plátano que crecen a la sombra.
Marín y Romero, (1992, datos sin publicar), en su estudio sobre la relación entre la densidad de siembra de banano respecto a la variable hoja más joven con mancha (HJM), observaron que partiendo de 1852 plantas/Ha hasta 2279 plantas/Ha, la enfermedad se agravó; sin embargo, al seguirse incrementando la densidad a una población de 2890 plantas/Ha, la tendencia fue inversa, es decir los valores de HJM aumentaron ligeramente. Se presume que el aumento del auto-sombreo en el dosel de la plantación en las densidades mayores, pudo de alguna manera estar relacionado con la observación de Bosogoro et al., (2004 a) y Bosogoro et al., (2004 b) sobre el efecto de la luz en la manifestación de la actividad de juglone.
Comentarios finales:
- Pseudocercospora fijiensis es un hongo hemibiotrófico, un período importante de su ciclo de vida en las células foliares actúa como un patógeno biotrófico, pero al final de su ciclo biológico es necrotrófico. Esta versatilidad le permite al patógeno responder eficientemente ante los mecanismos de defensa del huésped y perpetuar su alto potencial dañino.
- Como parte del ¨arsenal¨ que dispone P.fijiensis, se encuentra la liberación de micotoxinas, como el juglone y otras, que actúan de varias maneras a nivel de los cloroplastos, afectando el así el proceso fotosintético y con ello la reducción primaria de carbono, afectando directamente el peso del racimo.
- El juglone actúa en presencia de luz, pero hay también fitotoxinas producidas por el hongo, que pueden actuar en ausencia de luz.
Agradecimiento: Al Dr. Douglas Marín PhD., por la revisión del manuscrito y por sus acertadas recomendaciones.
Cita correcta de este artículo
Segura, M.A. 2020. Procesos Fisiológicos Involucrados en el Daño Producido por Pseudocercospora fijiensis en las Plantas de Banano (Musa spp): Efecto de la producción de micotoxinas (parte 1). Serie Frutales, Núm. 71. Artículos técnicos de INTAGRI. México. 8 p.
Literatura consultada
- Alakonya, A.E.; Kimunye, J.; Mahuku, G.; Amah, D.; Uwimana, B., Brown, A, Swennen, R. 2018. Progress in understanding Pseudocercospora banana pathogens and the development of resistant Musa germplasm. Plant Pathology. 67(4):759–770.
- Busogoro, J.P.; Etame´, J.J.; Lognay, G., Messiaen, J.; Van Cutsem, P.; Lepoire, P. 2004 b. Analysis of theMechanisms of Action of Mycosphaerella fijiensis Toxins During the Development of Black Leaf Streak Disease. In: Mohan, J.S., Swennen, R. (eds) Banana improvement: Cellular, Molecular Biology, and Induced muta- tionstions. Science Publishers, Enfield. 181 pp.
- Carlier, J.; Foure´, E., Gauhl, F.; Jones, D.R.; Lepoivre, P.; Mourichon, X. 2019. Fungal Diseases of the Foliage: Sigatoka leaf spots. CABI Publishing.
- Carlier, J.; Foure´, E.; Gauhl, F.; Jones, D.R. et al. 2019. Fungal Diseases of the Foliage. In: Jones DR (ed) Diseases of banana, abaca´ and ensent. CABI Publishing, Wallingford. 75 pp
- Chillet, M. et al. 2009. Sigatoka Disease Reduces the Greenlife of Bananas. Crop Protection. 28:41–45.
- Chillet, M.; Castelan, F.P.; Abadie, C.; Hubert, O.; Chilin-Charles, Y.; De Lapeyre De Bellaire, L. 2014. Effect of Different Levels of Sigatoka Disease Severity on Banana Pulp Colour and Early Ripening (en línea). Canadian Journal of Plant Pathology. 36:48–53.
- Cruz-Cruz, C.A. 2011. Physiological Effects of the Hydrophilic Phytotoxins Produced by Mycosphaerella fijiensis, the causal agent of black. J Gen Plant Pathol. 77:93–100
- Millet, J. 2010. Black Leaf Streak Disease is Challenging the Banana. Industry Fruits. 65:327–342.
- Ganry, J., Chillet, M. 2008. Methodology to Forecast the Harvest date of Banana Bunches. Fruits. 63:371–373.
- Guillermet, C.; Guen, C.R.; Dorel, D.; T. Lescot, T.; De Lapeyre de Bellaire, L. 2018. Experimental Approaches for Agro-Ecological Management of Black Leaf Streak in Dry and Humid Tropical Conditions. Acta Horticulture. 19 pp
- Hidalgo, W.; Chandran, J.N.; Menezes, R.C.; Otálvaro, F.; Schneider, B. 2016. Phenylphenalenones Protect Banana Plants from Infection by Mycosphaerella fijiensis and are Deactivated by Metabolic Conversion. Plant Cell and Environment 39:492–513.
- Hoss, R.; Helbig, J.; Bochow, H. 2000. Function of Host and Fungal Metabolites in Resistance Response of Banana and Plantain in the Black Sigatoka Disease Pathosystem (Musa spp.–Mycosphaerella fijiensis). Journal Phytopathology.148:387-394.
- Jullien, A.; Chillet, M.; Malezieux, E. 2008. Preharvest Growth and Development Determine Postharvest Green Life of Fruit in Musa (Musa sp. AAA group cv Grande Naine (Cavendish subgroup). Journal Horticultural Science Biotechnology. 83:506–512.
- Rodríguez, P.; Cayón, G. 2008. Efecto de Mycosphaerella fijiensis sobre la Fisiología de la Hoja de Banano. Agronomía Colombiana. 26:256-265.




Estimados colegas agronomos de INTAGRI agradezco comunicar estos artículos técnicos
Nos da gusto que los artículos le sean de utilidad, saludos y muchas gracias por su comentario.