Uso de Citoquininas de Síntesis Vía Riego para Mejorar el Desarrollo Radical en Uva de Mesa var. Red Globe
Autor: Dr. Thomas Fichet Lagos
Introducción
El siguiente artículo trata sobre un experimento realizado en el cultivo de Uva de mesa variedad Red Globe en tres portainjertos, con el objetivo de estudiar la respuesta de citoquininas (CPPU y TDZ) a la promoción del desarrollo radical. Muchos de nosotros aprendimos en las aulas de clase que las hormonas vegetales como las citoquininas hacían crecer las raíces junto con las auxinas. Además que una gran fuente de citoquininas eran justamente los meristemos radiculares. Sin embargo, las herramientas moleculares han permitido, en estos últimos 15 años, dilucidar realmente el aporte de estas y otras hormonas vegetales al desarrollo radical. Hoy por hoy se sabe que todas las fitohormonas (auxinas, giberelinas, citoquininas, etileno, ácido abcísico, jasmonatos, brasinoesteroides, ácido salicílico y estrigolactonas) participan en mayor o menor grado en el crecimiento de las raíces. Algunas de estas hormonas vegetales favorecen y otras inhiben el desarrollo de las raíces. Básicamente, porque as fitohormonas son señales endógenas que responden a una gran variedad de estímulos, tanto del medio interno como externo de la planta. La gran mayoría están interactuando durante el desarrollo de la planta. En el caso de la raíz principal como de las raíces laterales.
Ensayos de Citoquininas en Uva de Mesa
Para conocer el real aporte de las citoquininas de síntesis, en el desarrollo radical, se realizó un
|
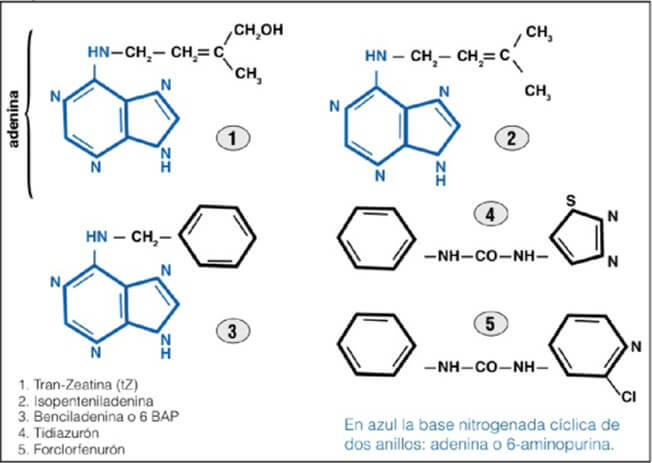
Figura 1. Estructura de citoquininas naturales y de síntesis. |
ensayo con plantas de uva de mesa var. Red Globe de un año de edad; injertadas sobre tres portainjertos diferentes (Freedom, Harmony y Ramsey). Las plantas estaban en macetas con un sustrato compuesto por 1/3 de turba, 1/3 de tierra agrícola y 1/3 de perlita. Los reguladores de crecimiento a base de citoquininas fueron: forclorfenurón (CPPU), y tidiazurón (TDZ), los cuales se aplicaron vía riego en las siguientes concentraciones: 0, 2.5; 5; 10; 15 y 20 mg/L. Los productos fueron aplicados en tres oportunidades (28 de diciembre, 6 y 11 de enero) cuando hubo una alta actividad radical y cada producto represento un ensayo individual. Las plantas fueron periódicamente fertilizadas con N, P, K y micronutrientes. Las evaluaciones se realizaron a los 60 días después de la última aplicación de los reguladores de crecimiento. Las variables evaluadas fueron: área de sección transversal de tronco (mm2 ASTT), numero de hojas del brote principal y hojas totales por planta, longitud del brote principal (cm), número y longitud de entrenudos (mm) del brote principal, peso fresco de la parte aérea y radical (g), área de las raíces (cm2) y peso seco de la parte aérea y radical (g).
Las distintas variables aéreas, medidas después de 60 días de postaplicación, no presentaron diferencias significativas con ninguno de los dos reguladores de crecimiento y tampoco con las concentraciones ensayadas. Estos resultados se deberían a dos situaciones posibles: 1) el tiempo transcurrido después de la última aplicación (60 días), no fue suficiente para que existiese translocación del ingrediente activo desde su punto de absorción (meristemos radicales) a la parte aérea y lograra ejercer su efecto, siendo poco el tiempo para visualizar síntomas en hojas y tallos, 2) existiría baja movilidad de ambas citoquininas de síntesis. Por lo tanto se habrían quedado a nivel radical ejerciendo un efecto localmente. En este último punto, existen varios antecedentes que podrían avalar esta falta de movimiento del (CPPU) (Biasi et al., 1993; Intrieri et al., 1993).
Sin embargo, por otro lado existen antecedentes de la movilidad de citoquininas endógenas dentro de la planta, como son trans-zeatina (tZ) o isopenteniladenina (iP). Estas hormonas vegetales utilizan transportadores de membrana, constituidos por una familia de proteína facilitadora (purina permeasa o PUP) y que son específicas para citoquininas, dado que reconocen la base nitrogenada cíclica de dos anillos (adenina o también conocida como 6-aminopurina) que es característica de las citoquininas endógenas y de la benciladenina o 6-benciaminopurina (Cedzich et al., 2008; Kudo et al., 2010; Qi y Lizhong 2013). Por el contrario, forclorfenurón y tidiazurón no están conformados, en su estructura, por adenina (Figura 1) lo que no les permitiría acoplarse a estos transportadores de membrana.
De ahí su baja movilidad, a través de las células vivas de las raíces, para llegar a los vasos conductores del xilema y desplazarse en forma acrópeta mediante flujo transpiratorio a la parte aérea de la planta. Aplicaciones de CPPU, marcado radiactivamente, han demostrado que queda fuertemente retenido en el sitio de aplicación y solo una muy baja cantidad es translocada a otras partes de la planta (Biasi et al., 1993; Letham, 1994). Si bien no hubo efecto de los reguladores de crecimiento, aplicados vía riego, en la parte aérea de las plantas de vid, si se observó un efecto notorio en el desarrollo radical, en los tres portainjertos ensayados. Tanto las plantas tratadas con forclorfenurón (Cuadro 1) como tidiazurón (Cuadro 3) vía riego, presentaron una disminución en el aérea de raíces de manera inversamente proporcional al aumento de la concentración del fitoregulador. Para forclorfenurón, solamente la concentración más alta (20mg.L-1) logro afectar significativamente el área radical, en cualquiera de los tres portainjertos ensayados (Figura 2). Sin embargo, hubo una tendencia a la disminución del área de raíces a partir de 5 mg.L-1 de CPPU. No solamente estas dos citoquininas de síntesis tienen un efecto inhibitorio en el desarrollo de las raíces, también aplicaciones al suelo de benciladenina afectan el crecimiento, tanto de la raíz principal como de las raíces laterales (Chang et al., 2013).
|
Cuadro 1. Efecto de distintas concentraciones de forclorfenuron (CPPU), vía riego, sobre área de raíces de tres portainjertos. |
||||||
|
CPPU (mg.L-1) |
||||||
|
Portainjerto |
0 |
2.5 |
5 |
10 |
15 |
20 |
|
cm2 |
||||||
|
Freedom |
465.87 a* |
467.83 a |
435.03 ab |
444.10 ab |
426.47 ab |
335.83 b |
|
Harmony |
426.77 a |
425.17 a |
408.30 ab |
417.13 ab |
402.90 ab |
328.87 b |
|
Ramsey |
455.87 a |
445.88 ab |
444.10 ab |
447.03 ab |
429.47 ab |
397.17 b |
En el Cuadro 2, se puede observar que tanto el peso fresco, como el peso seco de las raíces se vieron afectados con las aplicaciones de forclorfenurón, sobre todo a partir de concentraciones superiores o iguales a 5 mg.L-1. En el caso del tidiazurón, los portainjertos Freedom y Ramsey, se vieron afectados en su desarrollo radical a partir de 2.5 mg.L-1, no así Harmony el cual se afectó a partir de 5 mg.L-1 (Cuadro 3).
|
Cuadro 2. Efecto de distitntas concentraciones de forclorfenuron (CPPU), vía riego, sobre peso fresco (PF) y peso seco (PS) de raíces. |
|||||||
|
CPPU (mg.L-1) |
|||||||
|
Portainjerto |
0 |
2.5 |
5 |
10 |
15 |
20 |
|
|
gramos |
|||||||
|
Freedom |
PF |
14.20 a |
13.63 b |
13.31 b |
12.40 bc |
12.79 bc |
9.31 c |
|
|
PS |
5.90 a |
4.87 b |
4.20 bc |
4.27 bc |
4.16 bc |
3.19 c |
|
Harmony |
PF |
12.93 a |
10.27 b |
10.39 b |
9.76 bc |
9.70 bc |
7.91 c |
|
|
PS |
5.33 a |
3.73 ab |
3.43 bc |
3.37 bc |
2.83 bc |
2.53 c |
|
Ramsey |
PF |
17.97 b |
18.32 a |
18.01 ab |
16.01 bc |
15.13 bc |
10.87 c |
|
|
PS |
6.44 ab |
7.66 a |
5.61 bc |
5.77 bc |
5.23 bc |
2.99 c |
Estos resultados indicarían que tidiazurón tiene un efecto inhibitorio, sobre el desarrollo radical, superior a forclorfenurón. Algo muy similar a lo que ocurre en baya de uva de mesa, donde se requieren concentraciones inferiores de TDZ, con respecto a CPPU, para inducir un mismo crecimiento.
|
Cuadro 3. Efecto de distintas dosis de tidiazurón (TDZ) sobre área de raíces (cm2) en tres portainjertos de uva. |
||||||
|
TDZ (mg.L-1) |
||||||
|
Portainjerto |
0 |
2.5 |
5 |
10 |
15 |
20 |
|
cm2 |
||||||
|
Freedom |
456.30 a |
370.67 bc |
384.97 b |
359.97 bc |
356.53 bc |
314.57 c |
|
Harmony |
436.22 a |
443.17 a |
333.97 bc |
335.43 bc |
305.80 c |
326.83 bc |
|
Ramsey |
439.90 a |
385.76 bc |
398.51 b |
379.07 bc |
328.79 c |
369.93bc |
|
Cuadro 4. Efecto de diferentes concentraciones de tidiazurón sobre el preso fresco (PF) y seco (PS) de raíces de uva sobre tres portainjertos. |
|||||||
|
TDZ (mg.L-1) |
|||||||
|
Portainjerto |
0 |
2.5 |
5 |
10 |
15 |
20 |
|
|
gramos |
|||||||
|
Freedom |
PF |
12.91 a |
10.22 ab |
8.23 bc |
7.64 bc |
8.66 bc |
6.33 c |
|
|
PS |
5.34 a |
3.51 ab |
3.06 bc |
2.87 bc |
3.00 bc |
2.71 c |
|
Harmony |
PF |
10.80 a |
9.18 a |
6.83 bc |
7.07 b |
6.91 bc |
5.82 c |
|
|
PS |
3.53 a |
3.57 a |
2.60 b |
2.69 b |
2.53 b |
2.20 c |
|
Ramsey |
PF |
16.83 a |
14.03 b |
12.52 bc |
12.41 bc |
10.10 bc |
9.83 c |
|
|
PS |
4.92 a |
4.80 a |
4.20 b |
4.27 b |
3.17 bc |
3.03 c |
En el caso específico de la vid, Smart et al. (2003), señalan que varias citoquininas inhiben el desarrollo de raíces adventicias. En la actualidad, se conoce el mecanismo de bloqueo del crecimiento radical por parte de estas hormonas vegetales (Takatsuka y Umeda, 2014). El transporte de las auxinas, el ácido indol acético (IAA) la principal auxina en los vegetales, desde el ápice de la planta (lugar de producción) a la base de las raíces, es vía floema. Este último al estar constituido por células vivas, el paso del ácido indol acético, de células a células, es vía transportadores de membranas (proteínas especificas conocidas como PIN), que reconocen la auxina y la pasan de una célula a otra hasta llegar a las raíces donde finalmente induce el crecimiento a través de división, elongación y diferenciación celular. EL propio ácido indol acético, a medida que pasa por las células, va activando en el núcleo de la célula la síntesis de sus propias proteínas PIN. Estas proteínas, se ubican en la parte basal de la célula facilitando el paso del IAA a la siguiente célula. Sin embargo, las citoquininas a determinadas concentraciones, sean de síntesis o naturales, bloquean a nivel del núcleo la producción de transportadores de auxinas, evitando así que el IAA se pueda desplazar hasta los meristemos radicales e inducir crecimiento (Bishopp et al., 2011).

|
Figura 2. Efecto de distintas concentraciones de forclorfenuron sobre el desarrollo de raíces var. Red Globe injertadas sobre Harmony. |
Por tal motivo, las citoquininas no solo bloquean el crecimiento de la raíz principal, sino que también el crecimiento de raíces principales, mediante el bloqueo del movimiento del IAA. Básicamente, este es el mecanismo que habría activado el forclorfenurón y tidiazurón para, a partir de determinada concentración, inhibir el crecimiento radical bloqueando el movimiento de auxinas en las células de las raíces en los diferentes portainjertos utilizados en este ensayo.
Cita correcta de este artículo:
Fichet, L. T. 2018. Uso de Citoquininas de Síntesis Vía Riego para Mejorar el Desarrollo Radical en Uva de Mesa var. Red Globe. Serie Frutales Núm. 37. Artículos Técnicos de INTAGRI. México. 6 p.





Muy buen artículo, muy interesante. Me gustaría ahondar más en la parte de las poliaminas como reguladores de crecimiento.
Gracias por el comentario y aportación. Trabajaremos en el tema sugerido para llevarlo hasta ustedes.
Saludos.
Felicito a INTAGRI por sus excelentes artículos técnicos que publican periódicamente. No hay duda que la calidad de las investigaciones son la base para el desarrollo tecnológico y constituye el elemento de base para promover la Extensión o Asistencia Técnica para los productores.
Un saludo
MSc Edgar Berrios