Autor: Alvaro Segura Monge
Profesor de la Universidad de Costa Rica
La Sigatoka negra (SN) también conocida como BLSD, es causada por el hongo ascomiceto Pseudocercospora fijiensis M. Morelet-Deighton, anteriormente denominado como Mycosphaerella fijiensis M. Morelet (Arango-Isaza et al., 2016). Este hongo ha sido durante mucho tiempo una limitación importante para la producción de banano y plátano induciendo una defoliación severa y afectando el rendimiento en la mayoría de las zonas tropicales y subtropicales donde se cultivan bananas y plátanos (Carlier et al., 2000). Es una de las amenazas biológicas más graves para la producción de banano, para la seguridad alimentaria y la exportación a nivel global (Churchill, 2011).
El propósito de este trabajo es hacer una revisión de los procesos fisiológicos en la relación patógeno-planta de banano, que conducen a la disminución de la vida verde de la fruta de banano por efecto de la incidencia y severidad de P.fijiensis.
Impacto de la ¨Sigatoka negra¨ sobre la vida verde del banano:
La ¨Sigatoka negra`` provoca una reducción considerable de la fotosíntesis, una disminución del área foliar efectiva de la planta y del peso del racimo del banano (Hidalgo et al., 2006, Rodríguez y Cayón, 2008, Chillet, et al. 2014); sin embargo, el mayor daño causado por esta enfermedad, es por su efecto sobre la maduración temprana de la fruta, debido al acortamiento en la duración de la vida verde de la misma (Mobambo et al., 1993, Chillet et al., 2009; Castelán et al.,2012, Saraiva et al., 2013, Chillet et al., 2014, Guillemet et al., 2018). Adicionalmente Mobambo et al., (1993) observaron que las plantas afectadas por SN, mostraron un acortamiento del período entre floración y cosecha, en relación con las plantas testigo, con control de la enfermedad. La vida verde o período pre-climatérico (VV o GL) se define como el período comprendido entre la cosecha y el inicio de la maduración natural de la fruta. Durante el período pre-climatérico, los frutos verdes y maduros fisiológicamente, tienen una baja tasa de respiración y la producción de etileno es casi indetectable. La duración de la vida verde está determinada por varios factores, como la temperatura, la humedad relativa (HR), la concentración de oxígeno y la concentración de etileno circundante. Al inicio de la maduración de los frutos climatéricos, como el banano, se observa un rápido aumento de la respiración y la producción auto-catalítica de etileno. A partir de este momento se produce una cascada de reacciones enzimáticas asociadas a la de síntesis del etileno, dando inicio a la maduración del fruto y finalizando el período de vida verde. La fruta debe tener una vida verde lo suficientemente larga como para garantizar que la misma llegue sin madurar a los puertos de destino, donde será sometida a etileno exógeno en cuartos de maduración, hasta lograr el punto óptimo de maduración, el cual está definido por el tiempo que tome la distribución de la fruta hacia los puntos de venta, y con ello maximizar la condición de vida de anaquel.
Toda situación de estrés que afecte el normal crecimiento de las plantas en el campo (inundaciones, alta incidencia de la ¨Sigatoka negra¨, etc.), tiene un impacto negativo en la duración de la vida verde de la fruta, que afecta severamente a la industria bananera en términos de calidad y disponibilidad de la fruta en el mercado, lo cual se traduce en pérdida de rentabilidad para el productor y en el resto de la cadena del negocio.Recientemente se publicó una revisión exhaustiva del efecto de las condiciones de campo, la presión de enfermedades y otras tensiones ambientales, que tiene influencia sobre la vida verde del banano, mencionando la tecnología de pos-cosecha disponible a efecto de mantener la duración de la Vida verde, tanto como sea posible. (Brat et al., 2020) Jullien et al., (2008) indican que la vida verde depende de la edad fisiológica y esta, se expresa en unidades de calor y se determina a partir de la suma de la temperatura diaria media acumulada en el umbral de 14 ° C durante el período de floración a cosecha (Ganry y Meyer, 1975, Ganry y Chillet, 2008). Según Jullien et al., (2008) cuando el llenado de la pulpa de la fruta no se ve obstaculizado por ningún estrés en el cultivo, los bananos cosechados a los 900 grados día, bajo el umbral de los 14° C, alcanza una vida verde en aproximadamente 30 días a 20° C.
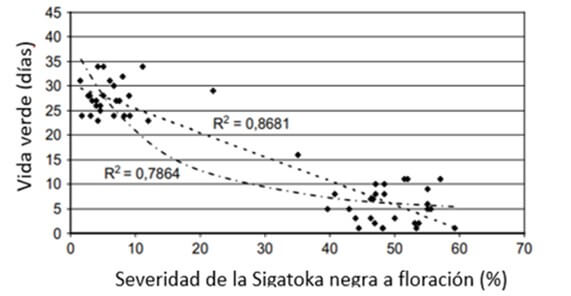
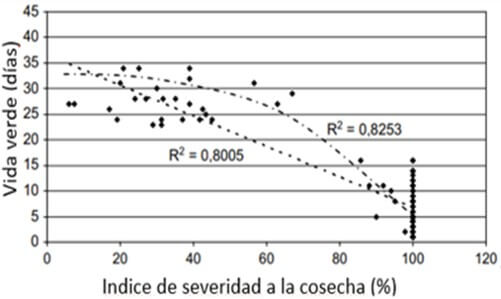
Según Chillet et al., (2009), el impacto de la ¨Sigatoka negra¨ es tan directo sobre la reducción de la vida verde, que aún a la floración, un aumento de la presión del hongo expresado en YLS (hoja más joven con estría), así como la severidad, tienen una relación inversa con la vida verde de la fruta (Figura 1). Esta relación tiene la misma tendencia, cuando se analiza el efecto del índice de severidad de la enfermedad a la cosecha, en relación a la vida verde al momento de la cosecha (Figura 2).
|
Figura 1. Relación entre el índice de severidad de la enfermedad a la floración y la vida verde del banano (Musa AAA, subgrupo Cavendish, “Grande Naine”) al momento de la floración. La fruta fue cosechada cuando alcanzó madurez a los 900 grados día. Fuente: Chillet, M. et al., 2009 |
|
Figura 2. Relación entre el índice de severidad de la enfermedad a la cosecha y la vida verde del banano (Musa AAA, subgrupo Cavendish, “Grande Naine”) al momento de la floración. La fruta fue cosechada cuando alcanzó madurez a los 900 grados día. Fuente: Chillet, M. et al., 2009 |
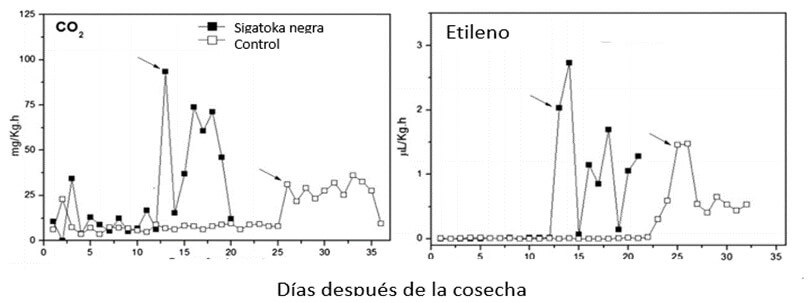
Los frutos climatéricos, como el banano, muestran un aumento dramático en la tasa de respiración durante la maduración y esto se conoce como respiración climatérica. Este aumento se produce simultáneamente con el incremento de la producción de etileno o un poco después (Kou y Mu, 2018). Durante la respiración, las plantas consumen O2 y liberan CO2. Castelán et al., (2012) observaron un aumento anticipado del pico climatérico y una mayor tasa de respiración y liberación de etileno en los frutos de banano (Musa AAA, Cavendish, ¨Naniçao¨) provenientes de lotes sin control de la ¨Sigatoka negra¨, el cual se expresó 10 días antes que en las frutas cosechadas de áreas con un buen control de la enfermedad (Figura 3). Este representa el acortamiento de la vida verde de la fruta debido al impacto de la enfermedad.
|
Figura 3: Tasa respiratoria y producción de etileno en frutos de banano (Musa AAA, subgrupo Cavendish, Nanicao) desde la cosecha hasta la senescencia, provenientes de áreas infestadas con y sin control de la ¨Sigatoka negra¨. La cosecha se realizó cuando los racimos alcanzaron 700 grados día. Las flechas indican el punto climatérico. Fuente: Castelán, F.P. et al. 2012. |
Indicaciones sobre las razones fisiológicas que provocan la disiminución de la vida verde en la fruta de banan o por acción de Pseudocercospora fijiensis
Según Mengiste (2012), las primeras etapas de las infecciones necrotróficas ocasionadas por patógenos en las hojas, se asocian con la muerte de la célula huésped y la producción de varios metabolitos secundarios, péptidos antimicrobianos y hormonas, como el etileno (ET), el ácido salicílico (SA), el ácido abscísico (ABA) y el jasmonato (JA).
1. Relaciones hormonales:
El etileno es un gas a temperatura y presión normal, que probablemente pasa a la atmósfera después que se genera en los tejidos afectados por P.fijiensis , cuando hay coalescencia de tejidos necrosados y en cuya periferia hay clorosis con tono naranja, probablemente asociado al efecto del etileno. Esta coloración es común en otro tipo de estrés, donde hay también producción de etileno , como por ejemplo cuando existen inundaciones que provocan anoxia (Glinski y Stepniewski 1985).
O bien cuando se inyecta ethrel (genera etileno) en los pseudotallos de la planta con el objetivo de matar el punto de crecimiento (figura 4 ). La formación de etileno en las raíces de las plantas requiere de la presencia de oxígeno; sin embargo, bajo condiciones de anoxia, producto del anegamiento, el ACC que es su precursor, es producido en las raíces y transportado a la parte aérea vía xilema, donde al haber presencia de oxígeno se transforma en etileno (Glinski y Stepniewski, 1985). Es improbable entonces, que el etileno generado en los tejidos foliares necrosados pueda ser transportado por el floema y llegar a la fruta.

|
Figura 4: Daño provocado por Pseudocercospora fijiensis (izquierda) y síntomas foliares provocados por las inundaciones (derecha). Ambos tipos de estrés provocan la senescencia de las hojas y el aspecto color marrón. Este gas se disipa en el ambiente. La inyección de ethrel a los pseudotallos de las plantas a efecto de matar el punto de crecimiento, emite etileno y causa síntomas similares en el follaje (no se muestra) |
En concordancia con lo sugerido por Chilet et al., (2013) y Guillermet et al., (2018), puede ocurrir un producción de metabolitos en las hojas afectadas por el P.fijiensis, que al ser transportados a la fruta vía floema, desencadenarían reacciones en cascada que provocan la reducción de la vida verde de la fruta.
Saraiva et al., (2013) determinaron los niveles de AIA, ABA y fenoles en frutos verdes y maduros provenientes de plantas con y sin control de la ¨Sigatoka negra¨ y cosechados a dos edades fisiológicas, 700 y 960 grados día. Así los frutos de las plantas sin control de la SN, cosechadas a 700 grados día tuvieron un 40% menos de IAA libre que los frutos del Control-700 y un 22% menos que los frutos del Control-960. Los mayores niveles de ABA fueron obtenidos en los bananos verdes cosechados en las parcelas sin control de la enfermedad, en comparación con los cosechados en la parcela de control, lo cual fue independiente de la edad fisiológica en la cosecha. Los frutos de Control-700 tenían un 28% menos de contenido de ABA que los frutos de plantas sin control de la SN-700. Los frutos de Control-960 tenían un 38% menos de contenido de ABA que los frutos de BLSD-700 (Cuadro 1).
|
Cuadro 1: Contenido de ácido indolacético, ácido abcísico y compuestos fenólicos en la pulpa de la fruta verde y madura de bananos `Nanicão` (Cavendish, AAA) cosechadas a diferentes edades fisiológicas, provenientes de plantas con y sin control de la ´Sigatoka negra. Fuente: Saraiva et al. (2013) |
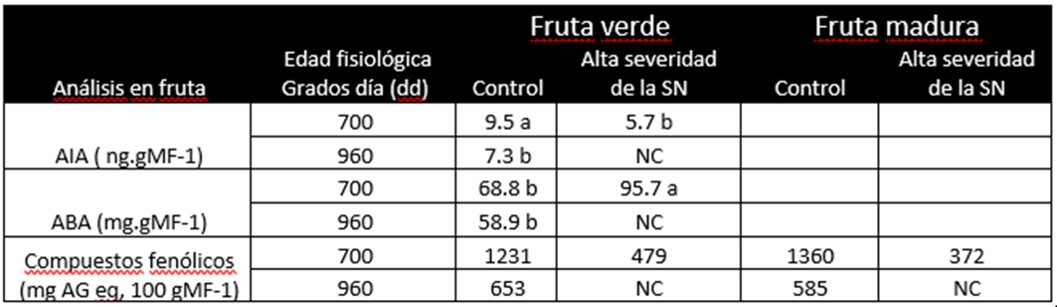
Según Saraiva et al., (2013) la disminución de los niveles de AIA parece estar correlacionada con el inicio de la maduración, comprobando así que los niveles libres de AIA deben reducirse para permitir cierta maduración, como la degradación del almidón y el posterior endulzamiento de los frutos.
De acuerdo con Saraiva et al., (2013) Pseudocercospora fijiensis, pudo haber dañado los meristemos foliares, uno de los principales sitios de síntesis de la IAA, y por lo tanto sería la causa principal de los bajos niveles de IAA en los frutos dañados por la ¨Sigatoka negra¨. Alternativamente, los niveles de ABA en los bananos verdes también juegan un papel en la iniciación de la maduración y en la secuencia de eventos de maduración mediada por etileno, aumentando la sensibilidad al etileno. Por lo tanto, cuanto más altos los niveles de ABA en el fruto verde, más rápido el inicio de la maduración (Cuadro 1). Según Jiang et al., (2000) el Ácido abscítico (ABA) aumenta la madura tanto climatérica como no climatérica; sin embargo, el mecanismo por el que la ABA estimula la producción de etileno no está claro. Algunos investigadores sugieren que ABA tiene un efecto directo sobre la bio-síntesis de etileno, principalmente a través de la mejora de la síntesis de ACC.
Las especies reactivas de oxígeno (ROS), como mediadores primarios del daño oxidativo en las plantas, están involucradas en la senescencia de los frutos. (Tian et al., 2013). En general, los frutos senescentes son fácilmente atacados por hongos los pueden acelerar enormemente la senescencia de los frutos después de la cosecha (Tian et al., 2013). La maduración del fruto, como fenómeno oxidativo, requiere la eliminación de ROS como el H2O2, y existe un equilibrio entre la producción de ROS y su eliminación por sistemas antioxidantes (Jimenez et al., 2002).
El banano (Musa spp.) acumula grandes cantidades de almidón durante el desarrollo (alrededor del 20% del peso fresco), que se convierte casi en su totalidad en azúcares solubles, principalmente sacarosa, durante la maduración (Garcia y Lajolo 1988).
La aplicación exógena de etileno en bananos pre-climatéricas, induce la biosíntesis autocatalítica de esta hormona, la degradación acelerada del almidón y la síntesis de sacarosa. En cambio, la aplicación exógena de las auxinas tiene el efecto contrario. En un modelo experimental con rodajas de plátano infiltradas, Vendrell (1969) observó que el ácido indol-3-acético (IAA) indujo un retraso en la maduración y en la acumulación de sólidos solubles totales.
Purgatto et al., (2001) demostraron que la aplicación de AIA a frutos de banano, indujo un retraso en la degradación del almidón. Este fue paralelo a una inhibición del gen del ARNm transcription de una β-amilasa en secciones tratados con AIA y a una disminución de la proteína β-amilasa. Cordenunsi y Lajolo (1995) observaron que la maduración de los bananos cuando están retenidos a la planta, requerió de 60 días más que la de los frutos cosechados y que los perfiles de las actividades de la sacarosa fosfato sintasa y la sacarosa sintasa, enzimas relacionadas con el metabolismo de la sacarosa, fueron alterados. Los autores señalan que el proceso de cosecha interrumpió el flujo de hormonas, como las auxinas de la planta a los frutos, lo que aceleró el proceso de maduración.
Purgato et al., (2001) y Purgato et al., (2002) determinaron que la aplicación de AIA tanto a secciones de fruta, como a frutos enteros del cultivar ¨ Nanicão¨, retrasó la degradación del almidón, pero este fue independiente de la síntesis de etileno y la respiración durante la fase climatérica, lo que sugiere que la degradación del almidón podría ser un proceso independiente del etileno o al menos parcialmente. Adicionalmente observaron que la infiltración de AIA no fue capaz de enmascarar la señal que surge como respuesta al desprendimiento de los frutos de la planta, ya que la activación de la síntesis de etileno después de la cosecha fue similar a las rebanadas de control. En relación con la degradación del almidón durante la maduración del banano, los niveles de AIA pueden considerarse como uno de los factores reguladores o al menos, un compuesto que puede retrasar eficientemente el inicio del proceso de maduración.
Ambas hormonas parecen estar relacionadas con la sensibilidad del banano al etileno, lo que indica un equilibrio coordinado de estas dos fitohormonas (IAA, ABA) y el etileno, en el proceso de maduración. Además, los niveles de estas hormonas en frutos con la enfermedad indican que el proceso de maduración fue avanzado por la presencia del patógeno en esas plantas. Por su parte Jiang et al., (2000) evaluaron el efecto de la infiltración al vacío de dosis crecientes de ABA (10-3, 10-4, 10-5 mol.L-1) en bananos verdes, sobre la respiración climatérica y encontraron que al aumentar las concentraciones, se adelantó el inicio del climaterio. Según los autores el ABA facilita la iniciación y el progreso en la secuencia de eventos de maduración mediados por el etileno, posiblemente aumentando la sensibilidad al etileno.
2. Metabolismo de azúcares:
Saraiva et al., (2013) sugieren que P.fijiensis afecta el metabolismo de los azúcares de la fruta en su desarrollo hasta alcanzar la cosecha y maduración. Los autores compararon los contenidos de almidón y azúcares totales (glucosa + fructuosa +sacarosa) en frutas de dos diferentes edades fisiológicas a la cosecha, (700 y 900 grados día) provenientes de plantas de banano (Nanicão, AAA) con y sin control de la ´Sigatoka negra´. Las frutas a la madurez fisiológica óptima (900 grados día) con control de la enfermedad, presentaron una concentración inicial normal en el contenido de almidón (20%). En las frutas cosechadas a una edad fisiológica de 700 grados día con control de la enfermedad, la concentración de almidón fue menor, por ser frutas más más jóvenes todavía en desarrollo y el peso de la fruta es menor. Los racimos cosechados a 700 grados día, pero sin control del patógeno, mostraron contenidos de almidón iniciales comparables a los de las frutas cosechadas más tardíamente (900 grados día), pero con más concentración de azúcares totales. (Figura 5)
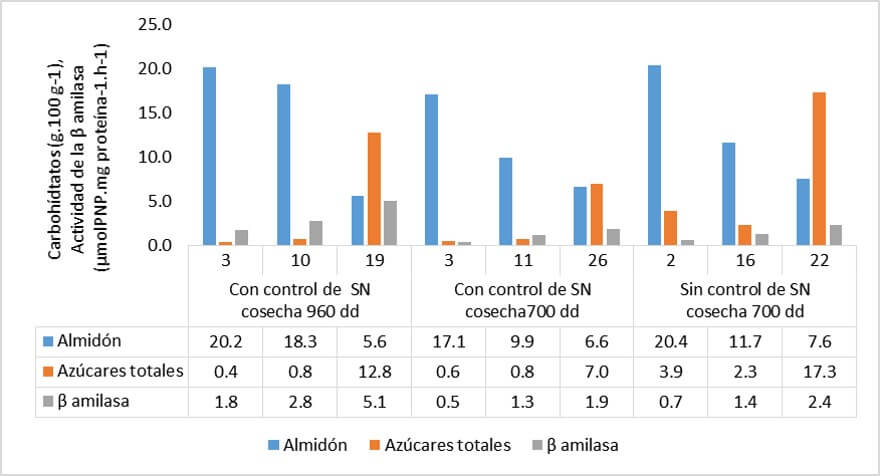
|
Figura 5: Contenido de Almidón, de azúcares solubles totales y actividad de la β-amilasa en frutos de banano `Nanicão` (Cavendish, AAA), cosechados a dos edades fisiológicas (700 y 960 grados día, dd) con y sin control de la Sigatoka negra (SN). Todos los racimos de las plantas con 960 dd, sin control de la enfermedad maduraron en el campo. Fuente: Saraiva et al. (2013) |
En adición a la disminución del peso de la fruta por efecto de la reducción de la actividad fotosintética foliar causada por P.fijiensis, hay que también considerar el efecto de la menor edad fisiológica y acortamiento de la vida verde de esta fruta, que implicaría también una pérdida de peso y calidad, por el menor contenido total de azúcares totales y de almidón. Esto último no es posible verificarlo por cuanto Saraiva et al., (2013) no aportaron datos sobre el peso de la fruta en su estudio.
La β-amilasa junto a la amino-fosforilasa, son las enzimas responsables de la degradación del almidón en los frutos de banano, pero también la amino-fosforilasa puede actuar en la síntesis de almidón (Soares et al., 2011). En las frutas cosechadas a 960 grados día, provenientes de plantas con control de la SN, la duración de la vida verde fue de 16 días y en la medida que transcurrió la degradación de almidón, aumentó la actividad de la β-amilasa (Figura 5). En las frutas cosechas a 700 grados día (con control de la SN), la vida verde fue de 26 días y la actividad de la β-amilasa fue menor, por cuanto la concentración el almidón que es su sustrato, fue mayor por ser una fruta más joven fisiológicamente. En las frutas cosechadas a 700 grados día (sin controlar la SN), la vida verde fue de 14 días y la actividad de la β-amilasa fue baja.
Hay dos mecanismos que regulan la degradación y síntesis de almidón en la fruta de banano. El primero en función de la disponibilidad de sustrato y el segundo, por la presencia de etileno en la etapa pre-climatérica. A mayor contenido de etileno, menor actividad de la enzima antes de la maduración. En la fruta cosechada de plantas con control de la SN, a 700 grados día, probablemente operó el primer mecanismo, pero en la cosechada a 700 grados día sin control de la enfermedad, se activó el segundo mecanismo, toda vez que hay una mayor emisión de etileno y acortamiento de la vida verde. (Saraiva et al., 2013)
Según Soares et al., (2011) la actividad y expresión de la amino-fosforilasa durante la maduración del banano, es sensible a los cambios en los niveles basales de etileno de manera negativa: los niveles más altos de etileno resultan en actividades de la enzima más bajos. Saraiva et al., (2013), encontraron que las frutas cosechadas a 900 grados día provenientes de plantas con control de la ¨Sigatoka negra¨, mostraron una alta actividad de la amino-fosforilasa contribuyendo a la degradación del almidón. En la fruta más joven (700 grados día) con control de la Sigatoka negra, la actividad de la amino-fosforilasa fue baja, por cuanto actúo sintetizando almidón. En la fruta jóven pero sin control de la Sigatoka negra, la actividad de la amino-fosforilasa tendió a aumentar, de manera que junto con la β-amilasa participaron tempranamente en la degradación del almidón. Saraiva et al. (2013), sugieren que la degradación del almidón en la fruta se inició antes de la cosecha, en las plantas afectadas por la enfermedad, probablemente como resultado del acortamiento del ciclo de vida de la planta por efecto del estrés que le causó P.fijiensis.
Saraiva et al. (2013), comprobaron que los granos de almidón de las frutas provenientes de plantas sin control de la enfermedad, fueron más pequeños en promedio, lo cual facilitó su degradación enzimática en un menor tiempo, lo cual es congruente con la menor vida verde en relación al testigo. Por su parte Shitakubo et al., (2010) mostraron que los frutos de plantas fuertemente infectadas con ´Sigatoka negra¨presentaron granos de almidón distorcionados.
3. Producción de fenoles:
Saraiba et al., (2013) encontraron que las muestras de banano del control cosechados a 700 grados día, contenían cantidades más altas (2 veces) de compuestos fenólicos en relación a las del control cosechado a 960 grados día. Los frutos afectados por la SN, cosechados a 700 grados día, mostraron menores contenidos de compuestos fenólicos solubles en comparación con los frutos control cosechados a 700 grados día. Los autores sugieren que la infección de P. fijiensis indujo una polimerización de los fenoles o bien que su síntesis, pudo haber sido afectado por la enfermedad, dado que los frutos afectados por la SN y cosechados a 700 grados día, contenían la menor cantidad de fenoles (Cuadro 1).
De acuerdo con Latqanzio et al., (2006), citados por Saraiba et al., (2013), los compuestos fenólicos involucrados en la defensa de las plantas contra patógenos, son constitutivos (presentes en las células) o bien sintetizados. Los constitutivos, son compuestos antifúngicos, como por ejemplo los fenoles simples, los ácidos fenólicos, los flavonoides. Estos actúan como compuestos antimicrobianos durante la defensa contra microorganismos. Los sintetizados se acumulan se acumulan en respuesta a la infección de un patógeno. Así la respuesta defensiva, implica un rápido aumento de compuestos fenólicos en el sitio de la infección, particularmente las fitoalexinas, las cuales igualmente pueden inhibir a una amplia gama de microorganismos.
El mayor contenido de compuestos fenólicos en frutas control cosechadas a 700 grados día y el menor en las frutas del control cosechados a 960 grados día y también afectados por la SN y cosechados a 700 grados día; sugieren una aceleración de la maduración fisiológica causada por la infección de la enfermedad (Cuadro 1)
4. Criterios para evaluar la óptima madurez fisiológica durante la cosecha:
También se han utilizado otros parámetros para ayudar a evaluar la madurez de la cosecha de las frutas, como los cambios en la firmeza de la fruta, el azúcar, la acidez, el almidón, la pectina, las enzimas, los cambios de color y los volátiles aromáticos (Kou y Mu, 2018). Chillet et al., (2014) mostraron que el color de la pulpa se ve muy afectado por la severidad de la ¨Sigatoka negra¨. Los autores encontraron (Cuadro 2), que cuanto mayor fue el nivel de la enfermedad, mayor la probabilidad de que la fruta perdiera su claridad (menor L *); apareció el enrojecimiento (positivo a *) y se reforzó la pérdida de verde y amarillo (aumento de b *). Por otra parte, los autores encontraron que a mayor severidad de la ¨Sigatoka negra¨, mayor fue el enrojecimiento de la pulpa de la fruta y mayor la disminución en la vida verde de la misma (Figura 6).
La maduración de frutos carnosos representa una coordinación de procesos bioquímicos que conducen a los cambios de color, textura, aroma y calidad nutricional de órganos maduros vegetales portadores de semillas. La hormona vegetal gaseosa etileno juega un papel clave regulador en la maduración de muchas frutas.
|
Cuadro 2. Cambio de color de la pulpa de frutos de banano (Musa AAA, Grande Naine) provenientes de racimos cosechados a 900 grados día, de lotes con diferentes grados de severidad de la “Sigatoka negra”. Fuente: Chillet, M. et al., 2014 |
|||
|
|
Color de la pulpa del banano |
||
|
IS |
L* |
a* |
b* |
|
1 |
88 a |
-2,00 c |
31 c |
|
2 |
86 a |
-1,00 b |
35 b |
|
3 |
84 b |
0,50 a |
39 a |
|
4 |
84 b |
0,76 a |
39 a |
|
F |
11.83 |
137, 87 |
32, 59 |
|
P |
0,005 |
<0.0001 |
<0,0001 |
IS: Índice de la Severidad de la Sigatoka negra. L*: intensidad. a*: mide los cambios de color verde (-) a rojo (+). B*: mide los cambios de color azul (-) a amarillo (+).
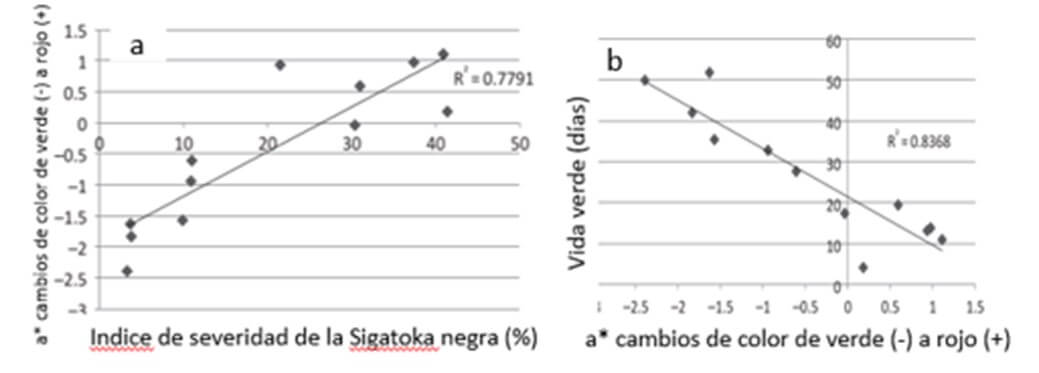
|
Figura 6. Cambio de color de la pulpa de banano en relación al índice de severidad de la “Sigatoka negra” (a) y respecto a la vida verde (b) de la fruta, de racimos de banano (Musa AAA, “Grande Naine”, cosechados cuando alcanzaron 900 grados día en áreas con y sin control de la enfermedad”. Fuente: Chillet, M. et al., 2014 |
Según Chillet et al., (2014), el color rojo en la pulpa de banano puede ser el resultado de la síntesis de antocianinas en respuesta al estrés foliar inducido por la enfermedad, debido a los mecanismos internos de transmisión de información que involucran hormonas vegetales como el ácido abscísico (ABA). El ABA juega un papel importante en las respuestas de las plantas al estrés (Zhang et al. 2006), especialmente en la infección por patógenos. Además, se ha demostrado que ABA es responsable de estimular la síntesis de antocianinas (Xu et al., 2018).
A nivel de empacadora y en forma empírica, existe la práctica de cortar un dedo de la segunda mano, a efecto de observar la textura y color de la pulpa, al punto que la fruta que tenga un color ¨salmón¨ o cremosa, se descarta por asociarse con fruta madura. De esta forma se presume que esta coloración crema, podría estar asociado con las tonalidades rojizas asociadas al acúmulo de antocianinas, anteriormente mencionado. Varios autores, indican que la inducción de la maduración en banano y en otros frutos no climatéricos, está regulada por la producción endógena de melatonina, una sustancia con propiedades de regulador de crecimiento, la cual induce la producción de ABA y H₂O₂, como paso preliminar a la inducción de etileno (Hu et al., 2017; Xu et al., 2018).
5. Hipótesis sobre los mecanismos fisiológicos que provocan la reducción de la vida verde de la fruta debido a Pseudocercospora fijiensis
Desde el punto de vista fisiológico, son varias las posibles causas que provocan la maduración anticipada de la fruta por efecto de la acción de P. fijiensis, por lo que habrá que esperar que se aporten datos sobre algunas conjeturas que existen. Se parte de la premisa, que la presencia de algún factor asociado a las lesiones del hongo en el follaje, pude eventualmente ser movilizado a la fruta.
- Participación de fitotoxinas (juglone): Determinar si las fitotoxinas (juglone) están también está involucradas en los mecanismos responsables de la reducción de la vida verde de la fruta en plantas de banano, infectadas a varios niveles con la enfermedad. No hay evidencias experimentales todavía. (Purgatto et al., 2001, 2002)
- Especies reactivas de oxígeno (ROS) también podrían tener un impacto. En el proceso de maduración convencional si hay intervención de la ROS; no obstante, la participación de P. fijiensis no está documentada (Rossetto et al., 2003; Chillet et al. 2009)
- Metabolitos intermedios como el metil-jasmonato y el ácido salicílico, que están involucrados en la relación huésped-patógeno, también tienen un efecto sobre la maduración de la fruta. No hay información disponible para el caso de banano.
- Hormonas: Algunas hormonas como la melatonina generada presumiblemente en la fruta tempranamente como respuesta al ataque del patógeno a la planta, puede provocar reacciones en cadena donde pueden participar el ABA y el H2O2, como moléculas precursoras de la síntesis de etileno. Castelán et al., 2012; Hu et al., 2017, Xu et al., 2018). Se tiene información que el AIA y el ABA tienen participación en el proceso de reducción de vida verde (Saraiva et al., 2013).
Comentarios finales:
- La maduración anticipada del banano es sin duda la forma más importante en que la Sigatoka negra afecta a la industria agroexportadora del banano. Está bien comprobada la disminución de la vida verde de la fruta, debido a un adelantamiento del pico climatérico en las frutas, provenientes de plantas afectas por la enfermedad.
- No hay evidencia experimental comprobada del mecanismo que conduce a la disminución de la vida verde por parte del hongo.
- El ataque de P. fijiensis causa una alteración en la síntesis de almidón y el metabolismo de los azúcares a nivel de fruta. El hongo provoca una reducción en el acúmulo de estas sustancias en todo el proceso de maduración fisiológica del fruto, independientemente de la producción de etileno. Por estas circunstancias la fruta afectada por el patógeno tiene menor contenido de estos, provocando una disminución del peso de los mismos y un acortamiento de la vida verde.
- Se presume que en respuesta a la producción de fitotoxinas por parte de P.fijiensis, se pueden activar procesos de hipersensibilidad por parte de la fruta, que conducen a la producción de ROS. Esta respuesta de los tejidos afectados por el patógeno, puede inducir reacciones, como la producción de melatonina, una sustancia similar al ácido indolacético (AIA), que a su vez puede conducir a la síntesis intermedia del ácido abscísico (ABA) y peróxido de hidrógeno (H2O2) y, finalmente a la síntesis temprana de etileno y a la maduración anticipada de la fruta.
- Hay equipos y técnicas ¨colorimétricas¨ que pueden ser valiosos para respaldar la cosecha de la fruta y con ello optimizar el peso y la vida verde de la fruta.
Agradecimiento: Al Dr. Douglas Marín PhD., por la revisión del manuscrito y por sus acertadas recomendaciones.
Cita correcta de este articulo
Segura, M. A. 2021. Procesos Fisiológicos Involucrados en el Daño Producido por Pseudocercospora fijiensis en las Plantas de Banano (Musa spp): Efecto sobre la Vida Verde de la Fruta (parte 4). Serie Frutales, Núm. 75. Artículos técnicos de INTAGRI. México. 15 p.
Literatura consultada
-Arango-Isaza, R.E., Diaz-Trujillo, C., Dhillon, B., Aerts, A., Carlier, J., Crane, C.F. 2016. Combating a Global Threat to a Clonal Crop: Banana Black Sigatoka Pathogen Pseudocercospora fijiensis (Synonym Mycosphaerella fijiensis) Genomes Reveal Clues for Disease Control. PLoS Genet 12(8): e1005876. doi: 10.1371/journal.pgen.1005876 PMID: 27512984.
-Brat, P., Bugaud, C., Guillermet, C.,Salmon, F. 2020. Review of banana green life throughout the food chain: From auto-catalytic induction to the optimisation of shipping and storage conditions (en línea). Scientia Horticulturae 262(September 2019):109054. DOI: https://doi.org/10.1016/j.scienta.2019.109054.
-Carlier, J., Foure´, E., Gauhl, F., Jones, D.R., Lepoivre, P., Mourichon, X. 2000. Fungal diseases of the foliage: Sigatoka leaf spots. In: Jones DR, editor. Diseases of Banana, Abaca´ and Enset. Wallingford, Oxon OX10 8DE UK: CABI Publishing. Chillet, M., Hubert, O., De Lapeyre, L. 2006. Postharvest disease: Effects of the physiological age of bananas (Musa spp.) on their susceptibility to wound anthracnose due to colletotrichum musae. Acta Horticulturae 879:419–424. DOI: https://doi.org/10.17660/ActaHortic.2010.879.46.
-Castelán, FP; Abadie, C; Hubert, O; Chilin-Charles, Y; de Lapeyre de Bellaire, L; Chillet, M. 2013. Relation between the severity of Sigatoka disease and banana quality characterized by pomological traits and fruit green life (en línea). Crop Protection 50:61–65. DOI: https://doi.org/10.1016/j.cropro.2013.02.019.
-Castelán, FP; Saraiva, LA; Lange, F; Bellaire, LDL De; Cordenunsi, BR; Chillet, M. 2012. Effects of Black Leaf Streak Disease and Sigatoka Disease on fruit quality and maturation process of bananas produced in the subtropical conditions of southern Brazil (en línea). Crop Protection 35:127–131. DOI: https://doi.org/10.1016/j.cropro.2011.08.002.1.
-Chillet, M., Hubert, O., De Lapeyre, L. 2006. Postharvest disease: Effects of the physiological age of bananas (Musa spp.) on their susceptibility to wound anthracnose due to Colletotrichum musae. Acta Horticulturae 879:419–424. DOI: https://doi.org/10.17660/ActaHortic.2010.879.46
-Chillet, M. et al. 2009. Sigatoka Disease Reduces the Greenlife of Bananas. Crop Protection. 28:41–45.
-Chillet, M; Castelan, FP; Abadie, C; Hubert, O; De Lapeyre De Bellaire, L. 2013. Necrotic leaf removal, a key component of integrated management of Mycospaerella leaf spot diseases to improve the quality of banana: The case of Sigatoka disease. Fruits 68(4):271–277. DOI: https://doi.org/10.1051/fruits/2013073.
-Chillet, M.; Castelan, F.P.; Abadie, C.; Hubert, O.; Chilin-Charles, Y.; De Lapeyre De Bellaire, L. 2014. Effect of Different Levels of Sigatoka Disease Severity on Banana Pulp Colour and Early Ripening (en línea). Canadian Journal of Plant Pathology. 36:48–53.
-Churchill, A.C.L. 2011. Mycosphaerella fijiensis, the black leaf streak pathogen of banana: Progress towards understanding pathogen biology and detection, disease development, and the challenges of control. Molecular Plant Pathology 12(4):307–328. DOI: https://doi.org/10.1111/j.1364-3703.2010.00672.x.
-Cordenunsi BR, Lajolo FM (1995) Starch breakdown during banana ri- pening – Sucrose synthase and sucrose-phosphate synthase. J Agric Food Chem 43: 347–351
-Ganry, J., Meyer, J.P. 1975. Recherche d’une loi d’action de la température sur la croissance des fruits du bananier. Fruits. 30:375–392.
-Ganry, J., Chillet, M. 2008. Methodology to Forecast the Harvest date of Banana Bunches. Fruits. 63:371–373.
-García, E., Lajolo, F. 1988. Starch Transformation During Banana Ripening: The Amylase and GlucosidasBehavior. Food Science. 54: 1181-1186.
-Glinski, J; Stepniewski, W. 1985. Soil Aerationand Its Role for Plants. New York, CRC Press. 1–219 p.
-Guillermet, C; Le Guen, R; Dorel, M; Lescot, T; de Lapeyre de Bellaire, L. 2018. Experimental approaches for agro-ecological management of black leaf streak in dry and humid tropical conditions (en línea). Acta Horticulturae (1196):113–120. DOI: https://doi.org/10.17660/ActaHortic.2018.1196.13.
-Hidalgo, M., Tapia, A., Rodriguez, W., Serrano, E. 2006. Efecto De La Sigatoka Negra Sobre La Fotosíntesis Y Transpiración Foliar Del Banano. Agronomía Costarrricense 30(1):35–41.
-Hu, W., Yang, H., Tie, W., Yan, Y., Ding, Z., Liu, Y., Wu, C., Wang, J., Reiter, R.J.,Tan, D.X., Shi, H., Xu, B., Jin, Z.. 2017. Natural Variation in Banana Varieties Highlights the Role of Melatonin in Postharvest Ripening and Quality. Journal of Agricultural and Food Chemistry 65:9987–9994. DOI: https://doi.org/10.1021/acs.jafc.7b03354.
-Jiang, Y; Joyce, DC; Macnish, AJ. 2000. Effect of abscisic acid on banana fruit ripening in relation to the role of ethylene. Journal of Plant Growth Regulation 19(1):106–111. DOI: https://doi.org/10.1007/s003440000011.
-Jimenez A, Creissen G, Kular B et al. 2002. Changes in oxidative processes and components of the antioxidant system during tomato fruit ripening. Planta 214:751–758
-Jullien, A.; Chillet, M.; Malezieux, E. 2008. Preharvest Growth and Development Determine Postharvest Green Life of Fruit in Musa (Musa sp. AAA group cv Grande Naine (Cavendish subgroup). Journal Horticultural Science Biotechnology. 83:506–512.
-Kou, X; Wu, M. 2018. Characterization of climacteric and non-climacteric fruit ripening. Methods in Molecular Biology 1744:89–102. DOI: https://doi.org/10.1007/978-1-4939-7672-0_7.
-Mengiste, T. 2012. Plant immunity to necrotrophs. Annual Review of Phytopathology 50:267–294. DOI: https://doi.org/10.1146/annurev-phyto-081211-172955.
-Mobambo, K.N., Gauhl, F., Vuylsteke, D., Ortiz, R., Pasberg-Gauhl, C. and Swennen, R. (1993) Yield loss in plantain from black Sigatoka leaf spot and field performance of resistant hybrids. Field Crops Research 35, 35–42
-Purgatto, E.; Nascimento, J.R.O.; Lajolo, F.M. 2001. Inhibition of Beta-amylase Activity, Starch Degradation and Sucrose Formation by Indole-3-acetic Acid During Banana Ripening. Planta. 212: 823–828.
-Purgatto E., Lajolo FM, Nascimento J.R.O., Cordenunsi BR. 200. Inhibition of β-amylase activity, starch degradation and sucrose formation by indole-3-acetic acid during banana ripening. Planta 212: 823–828.
-Purgatto, E.; Lajolo, F.M.; Nascimento, J.R.O. 2002. The Onset of Starch Degradation During Banana Ripening is Concomitant to Changes in the Content of Free and Conjugated Forms Ofindole-3-acetic acid. Journal of Plant Physiology. 159: 105–111.
-Rodríguez, G.C., Cayón S.D.G., Mira, C.J.J. 2006. Número mínimo de hojas funcionales a floración y cosecha en banano (Musa AAA Simmonds) en Urabá, Colombia. In: Soprano E, Adami TF, Lichtemberg LA.
-Rodríguez, P.; Cayón, G. 2008. Efecto de Mycosphaerella fijiensis sobre la Fisiología de la Hoja de Banano. Agronomía Colombiana. 26:256-265.
-Rossetto, M.R.M., Purgatto, E., Lajolo, F.M., 2003. Effects of gibberellic acid on sucrose accumulation and sucrose biosynthetising enzymes in bananas. Plant Growth Regulation 41, 207–214.
-Saraiva, LDA; Castelan, FP; Shitakubo, R; Hassimotto, NMA; Purgatto, E; Chillet, M; Cordenunsi, BR. 2013. Black leaf streak disease affects starch metabolism in banana fruit. Journal of Agricultural and Food Chemistry 61(23):5582–5589. DOI: https://doi.org/10.1021/jf400481c.
-Silva MC, editors. XVII ACORBAT, Brazil, 15–20 octubre 2006, Joinville (Santa Catalina). p. 318–319.
-Shitakubo, R., Castelan, F.P., Saraiva, L.A., Okita Peroni, F.H.G., Chillet, M., Cordenunsi, B., 2010. Characterization of the surface of starch granules of bananas with black leaf streak disease and Sigatoka diseases. Braz. J. Pharm. Sci. 46 (Suppl. 2), 74
-Soares, C. A.; Peroni-Okita, F. H. G.; Cardoso, M. B.; Shitakubo,R.; Lajolo, F. M.; Cordenunsi, B. R. 2011. Plantain and banana starches: granule structural characteristics explain the differences in their starch degradation patterns. J. Agric. Food Chem. 59: 6672−6681.
-Tian, S; Qin, G; Li, B. 2013. Reactive oxygen species involved in regulating fruit senescence and fungal pathogenicity. Plant Molecular Biology 82(6):593–602. DOI: https://doi.org/10.1007/s11103-013-0035-2.
-Vendrell, M. Reversion of senescence: effects of 2,4-dichlo- rophenoxyacetic acid and indoleacetic acid on respiration,ethylene production, and ripening of banana fruit slices. Aust. J. Biol. Sci. 1969, 22, 601-10.
- Xu, L., Yue, Q., Xiang, G., Bian, F., Yao, Y. 2018. Melatonin promotes ripening of grape berry via increasing the levels of ABA, H2O2, and particularly ethylene (en línea). Horticulture Research 5(1). DOI: https://doi.org/10.1038/s41438-018-0045-y.



Aún no hay comentarios sobre el artículo