Autor: Alvaro Segura Monge
Profesor de la Universidad de Costa Rica
En años recientes el cultivo de banano (Musa spp.) ha sido severamente afectado por la enfermedad conocida como ¨marchitez por fusarium¨. Enfermedad causada por el hongo Fusarium oxysporum f. sp. cubense (Foc). Particularmente por una raza altamente virulenta, la raza tropical 4 (TR4), la cual es sumamente letal a los principales cultivares comerciales pertenecientes al sub-grupo Cavendish, que representan aproximadamente el 45% de la producción bananera global (Ploetz, 2015). El hongo causa una obstrucción de los conductos xilemáticos de la planta y eventualmente causa la muerte de la misma. El patógeno se disemina rápidamente en áreas infectadas a través de tejidos dañados, en el agua de irrigación, el salpique de la lluvia, en condiciones de inundaciones por el arrastre del hongo, en herramientas contaminadas, en las partículas de suelo adheridas al calzado o en equipos y maquinarias, por medio de animales de corral o bien por medio de Cosmopolites sordidus, entre otras vías. Por el momento no existe un método efectivo de control en campos infectados con esta enfermedad (Ploetz, 2006 y 2015).
Síntomas y daños del Foc
El primer síntoma interno del daño producido por la ¨marchitez por fusarium¨ es la decoloración café-rojiza del xilema que se extiende a las raíces absorbentes (Ploetz 2006). Usando la técnica del GFP (Green Fluorescense Protein) se ha observado que Foc invade las células epidérmicas de las partes apicales y zonas de elongación de las raíces, así como raíces laterales dañadas (Warman et al., 2018). De acuerdo con Dong et al. (2014) los síntomas de clorosis provocada por la enfermedad son visibles después de 15 días de la inoculación, en las hojas basales y su posterior progreso hacia las hojas jóvenes (Figura 1).

|
Figura 1. Clorosis en hojas basales de banano (Musa AAA) ‘Gros Michael’ 15 días después de la inoculación con Foc. Fuente: Dong et al., 2014. |
Según Dong et al. (2014) la fotosíntesis neta foliar de plantas inoculadas con Foc, decrece severamente a partir del cuarto día de la inoculación con el patógeno (Figura 2A); no obstante las plantas testigo, muestran una tasa fotosintética constante durante todo el período que duró el experimento. Las hojas más jóvenes mostraron tasas fotosintéticas mayores que las más basales. Tanto la conductancia estomática (que es inversamente proporcional a la apertura estomática) como la transpiración, son mayores en las hojas de plantas no inoculadas respecto a las inoculadas con Foc (Figuras 2B y 2C). De igual manera, estas dos variables son mayores en las hojas jóvenes de las plantas. El cierre estomático, la disminución en la transpiración y en la fotosíntesis de las plantas inoculadas con Foc, se inicia tan solo dos y cuatro días después de la inoculación en hojas viejas y nuevas, respectivamente (Dong et al., 2014).
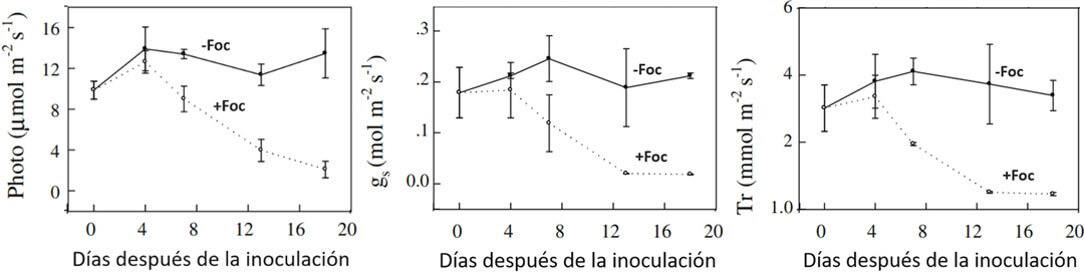
|
Figura 2. Efecto de la inoculación con Foc a las raíces de banano (Musa AAA) ‘Gros Michel’ sobre la fotosíntesis neta (A), la conductancia estomática (B) y la transpiración (C). Fuente: Dong et al., 2014. |
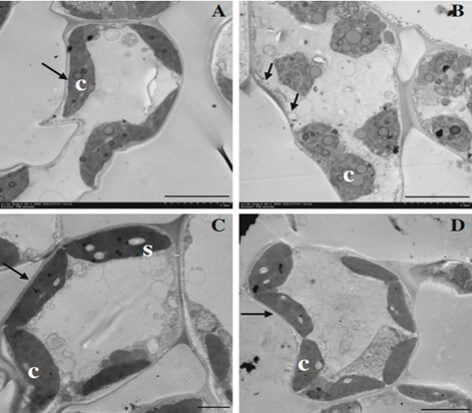
Las imágenes de microscopía electrónica (Figura 3) muestran que en las hojas basales de banano, la inoculación con Foc causa un severo daño a la integridad de las membranas plasmáticas y a los cloroplastos de las células del mesófilo; sin embargo, este daño no se observa en las hojas jóvenes y desde luego tampoco en las plantas no inoculadas con el patógeno (Dong et al., 2014).
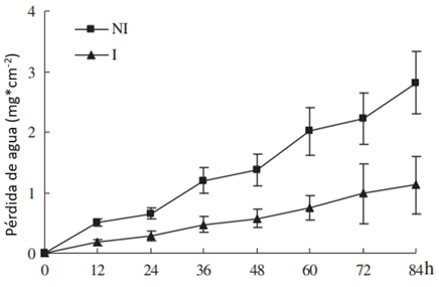
Dong et al. (2012) evaluaron el efecto de la inoculación con Foc sobre diversas variables fisiológicas, observando que en relación a plantas no inoculadas con el patógeno, las plantas enfermas tuvieron una menor apertura estomática, una menor tasa transpiratoria y un menor potencial hídrico. Por tanto, los autores sugieren que en plantas enfermas ocurre una pérdida de agua acelerada que provoca la marchitez de la planta (Figura 4) y un aumento de la temperatura de las hojas en relación a las plantas sanas (Figura 5), producto del cierre de las estomas y consecuentemente del aumento de la temperatura por la nula o baja refrigeración.
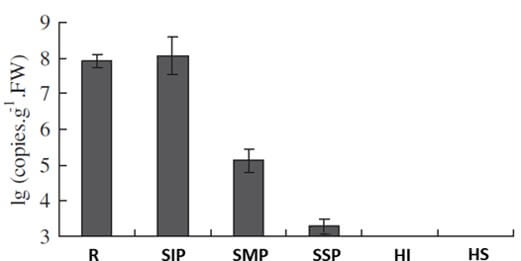
Adicionalmente, no observaron colonias de Foc en las hojas infectadas con el patógeno (Figuras 6 y 7); sin embargo, en un análisis posterior de toxinas del extracto crudo de las colonias del patógeno, fue encontrando el ácido fusárico (Dong et al., 2012).
|
Figura 4. Efecto de la infección con Foc, sobre la pérdida de agua de plantas de banano (Musa AAA) ‘Gros Michel’. NI (plantas no inoculadas) e I (plantas infectadas). Fuente: Dong et al., 2012. |
|
Figura 3. Células del mesófilo de hojas de banano (Musa AAA ‘Gros Michel’) no infectadas e infectadas con Foc. (A) células del mesófilo de hojas basales de plantas no infectadas, mostrando membranas celulares y cloroplastos intactos. (B) células de hojas basales de plantas infectadas, mostrando una fuerte ruptura de la membrana celular, atrofia de los cloroplastos, no se observan gránulos de almidón y la presencia de numerosos de gránulos osmeofíticos en los cloroplastos. (C) células del mesófilo de hojas apicales de plantas no infectadas, mostrando membranas celulares y cloroplastos intactos, los gránulos de almidón claramente discernibles. (D) células de hojas apicales infectadas, mostrando las membranas y los cloroplastos intactos. Fuente: Dong et al., 2014. |

|
Figura 5. A) Imágenes de reflectancia de plantas no inoculadas e inoculadas con Foc (izquierda y derecha respectivamente en cada imagen). B) Imágenes termográficas infrarrojo. La temperatura de las hojas de plantas no inoculadas e inoculadas fue de 25.3 °C y 27. 6 °C, respectivamente. Fuente: Dong et al., 2012. |
|
Figura 6. Determinación de la presencia de colonias de Foc en plantas de banano (Musa AAA, ‘Gros Michael’) con 6 hojas, síntomas de la enfermedad, las cuales fueron seccionadas en seis partes: raíces (R), las sección inferior del pseudotallo (SIP), la sección media del pseudotallo (SMP), la sección superior del pseudotallo (SSP), las hojas inferiores (HI) y las hojas superiores (HS). Fuente: Dong et al., 2012. |
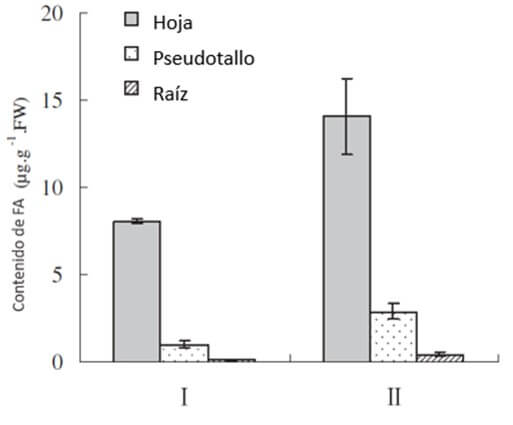
|
Figura 7. Distribución del ácido fusárico (FA) en tres posiciones (hoja, pseudotallo y raíces de plantas de banano Musa AAA, ‘Gros Michel’ inoculadas con Foc, con síntomas de clorosis leves (I) y fuertes (II). Fuente: Dong et al., 2012. |

|
Figura 7.1. Presencia de Foc en la vena central de las hojas en la zona de emergencia de hojas nuevas de ‘Lady finger´. (a) 50 días después de la inoculación con Foc GFT, mostrando síntomas leves de la enfermedad. (b) Hifas y microconidios localizados en la zona no descolorida de xilema de la vena central en el punto donde se emiten hojas nuevas. (c) Hojas de ‘Williams’ 50 días después de la inoculación, con microconidios germinados localizados en los conductos de xilema. (d) ‘Lady finger’ 60 días después de la inoculación con una proliferación extensiva de micelio bloqueando a los conductos de xilema. Fuente: Warman y Aitken, 2018. |
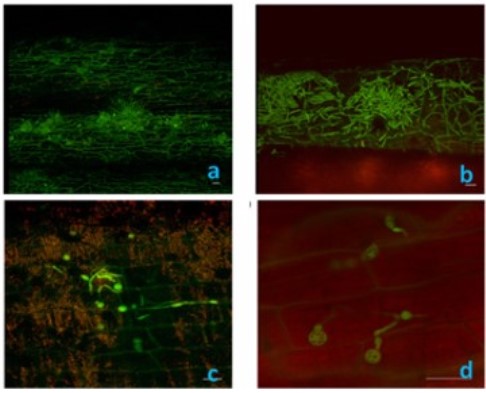
|
Figura 7.2. Presencia de Foc GFT en la parte externa de vainas senescentes y muertas de ‘Williams’. (a) 50 días después de la inoculación, 10 a 15 cm sobre el rizoma, mostrando micelios. (b) 40 días después de la inoculación, 10 a 15 cm por encima del rizoma, mostrando una gran proliferación de macroconidios en la parte externa de las vainas. (c) Pseudotallos de ‘Williams’ 80 días después de la inoculación, 5 a 10 cm por encima del rizoma, mostrando la presencia de clamidosporas en la parte externa de las vainas. (d) Pseudotallos de ‘Lady finger’ 70 días después de la inoculación, 0 a 5 cm por encima del rizoma, mostrando clamidosporas en las vainas senescentes. Fuente: Warman y Aitken, 2018. |
Warman et al. (2018) observaron que aún antes de que aparezcan los síntomas de la ¨marchitez por fusarium¨, hay un movimiento y confinamiento de Foc en los tejidos de xilema; no obstante, cuando la enfermedad avanza y hay muerte de tejidos, se observa la habilidad del patógeno para desplazarse a las vainas exteriores del pseudotallo, produciendo estructuras de propagación como macroconidios y clamidosporas (Figura 7.2), las cuales se pueden convertir en un medio de diseminación de la enfermedad, por acción física o cualquier otro medio de transporte de estas estructuras hacia individuos sanos. De igual manera, la presencia del patógeno en las venas centrales de las hojas del banano, podrían potencializar la diseminación del hongo, como consecuencia las prácticas de deshoje y saneamiento, de uso muy convencional en el manejo fitosanitario de la ¨sigatoka negra¨ (Pseudocercospora fijiensis).
Li et al. (2017) inocularon Foc raza 1 (GFP) y TR4 (GFP) en plantas de Cavendish (Musa AAA, cultivar ‘Brazil’), resistentes y susceptibles a estas razas, respectivamente y acompañaron el proceso de infección del hongo por medio de la fluorescencia de las estructuras del patógeno en raíces y rizoma. Foc raza 1 es capaz de ingresar a las raíces de la planta a través de heridas, pero no por medio de espacios intercelulares; sin embargo, Foc TR4 puede penetrar al huésped por ambas vías. A diferencia de Foc raza 1, la TR4 fue capaz de invadir los tejidos vasculares del rizoma de la planta y producir los síntomas de marchitez típicos. A pesar de que Foc raza 1 puede infectar algunos tejidos vasculares del rizoma, su nivel de infección no afectó el crecimiento de las plantas y no provocó marchitez. Según los autores, la infección de Foc TR4 puede ser retardada o controlada si de alguna manera se pudiera prevenir el ingreso del patógeno al rizoma o bien controlar la propagación del hongo en esta sección de la planta.
Dong et al. (2012) trataron plantas sanas de banano con extractos crudos de las colonias de Foc y con ácido fusárico puro, observando el mismo patrón en las variables fisiológicas de las hojas, que el obtenido con la inoculación de patógeno. En la Figura 8, se observa el efecto del ácido fusárico sobre la pérdida de agua de la planta.
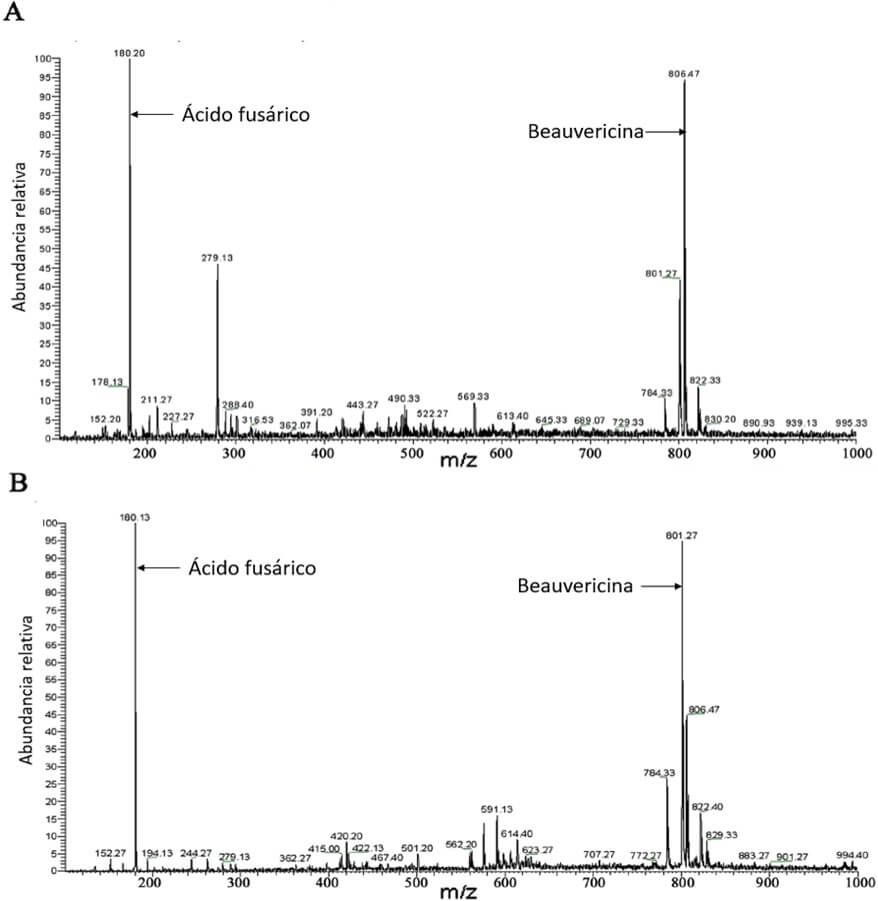
Li et al. (2013) realizaron una evaluación de la patogenicidad y concentración de beauvericina y ácido fusárico de veinte aislamientos de Foc. Para ambas fitotoxinas, existe una alta correlación entre ambas variables en las raíces, pseudotallos y hojas de las plantas inoculadas (Figuras 9 y 10), respecto a la agresividad de los aislamientos de Foc.
Li et al. (2013) observaron que de todas las micotoxinas analizadas, solamente el ácido fusárico y la beauvericina fueron encontradas en los aislamientos de Foc raza 1 y 4 (Figura 11).
A efecto de colonizar la planta huésped, los hongos se adaptan al ambiente hostil y realizan un ajuste de su metabolismo, morfología y fisiología (Michielse, 2009). El proceso de infección de Fusarium oxysporum puede dividirse en varias partes. Reconocimiento de las raíces, contacto superficial con las raíces y colonización, penetración y colonización del córtex y proliferación de las hifas dentro de los conductos de xilema.
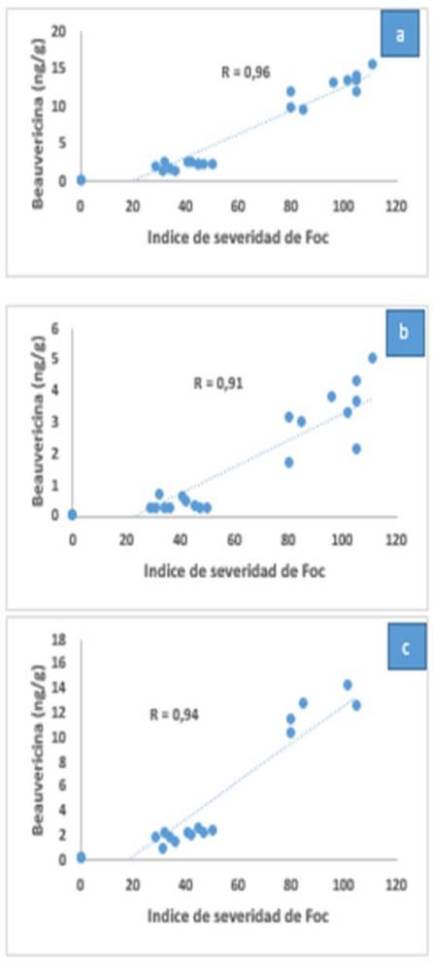
|
Figura 9. Correlación entre la patogenicidad de 20 aislamientos de Foc y la concentración de beauvericina en raíces (a), hojas (b) y pseudotallos (c) de plantas de Pisang Awak cv ‘GuanFen #1’ (Musa ABB) y Cavendish cv ‘Brazilian’. Fuente: Adaptado de Li et al., 2013. |
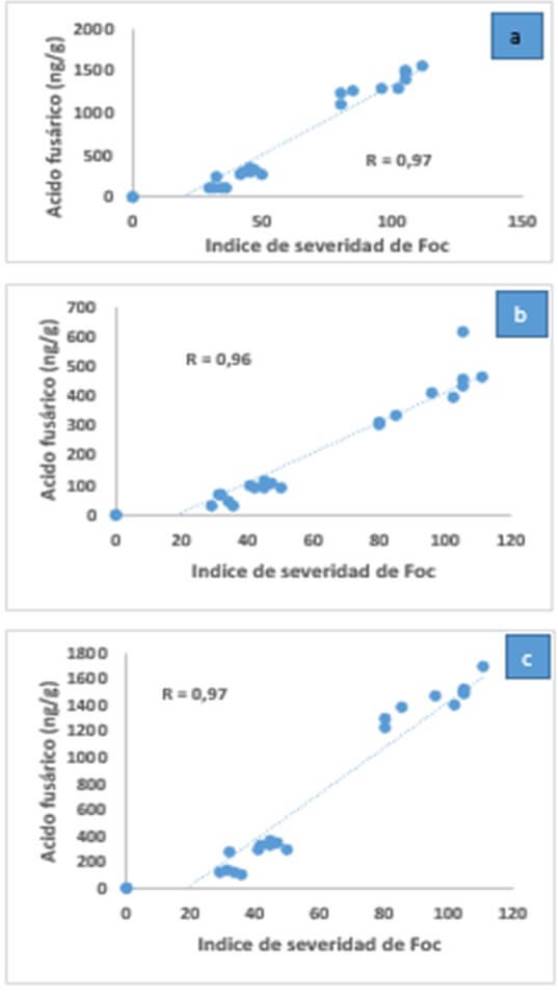
|
Figura 10. Correlación entre la patogenicidad de 20 aislamientos de Foc y la concentración de ácido fusárico en raíces (a), hojas (b) y pseudotallos (c) de plantas de Pisang Awak cv ‘GuanFen #1’ (Musa ABB) y Cavendish cv ‘Brazilian’. Fuente: Adaptado de Li et al., 2013. |
Una vez que Fusarium oxysporum llega a los conductos de xilema, este se expande dentro de la planta por medio de la proliferación de hifas y la producción de microconidios (Pietro, 2003, Czymmek, 2007). Una serie de reacciones ocurren en las plantas infectadas a efecto de bloquear al patógeno, tal como la producción de geles, gomas, calosa y tilosa (Krivane et al., 2005, Scheckler y Galitier, 2003).
|
Figura 11. Perfil cromatográfico de los metabolitos secundarios de Foc para aislamientos de raza 1 (A) y 4 (B), respectivamente. Fuente: Li et al., 2013. |
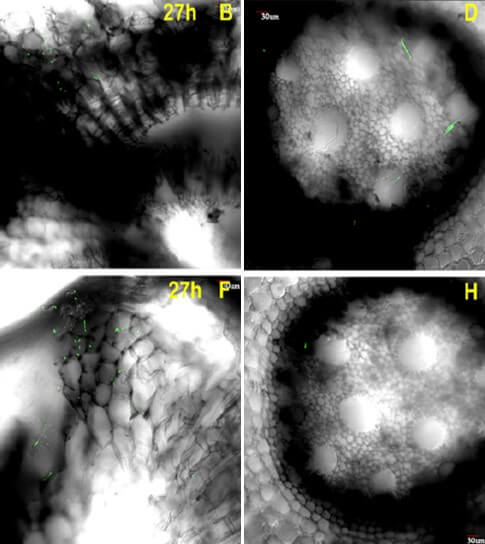
Según Li et al. (2017) Foc, usualmente invade completamente el sistema vascular de los pseudotallos de las plantas susceptibles después de su penetración a las plantas. Por medio de la técnica de GFP las colonias del hongo son identificadas debido a la excitación y fluorescencia al irradiarse con luz ultravioleta. Foc TR4 fue monitoreada para acompañar el proceso de infección en plantas susceptibles y resistentes al patógeno. Se observó que hifas y esporas del hongo se adhieren a las células epidérmicas de las raíces tan solo 3 horas después de la infección y penetraron el parénquima del córtex 27 horas después de la infección. A las 51 horas, una gran cantidad de hifas y esporas fueron detectadas en la endodermis y en los tejidos vasculares tanto en plantas resistentes como susceptibles al patógeno, por lo que no hubo diferencias en el proceso de infección (Figura 12).
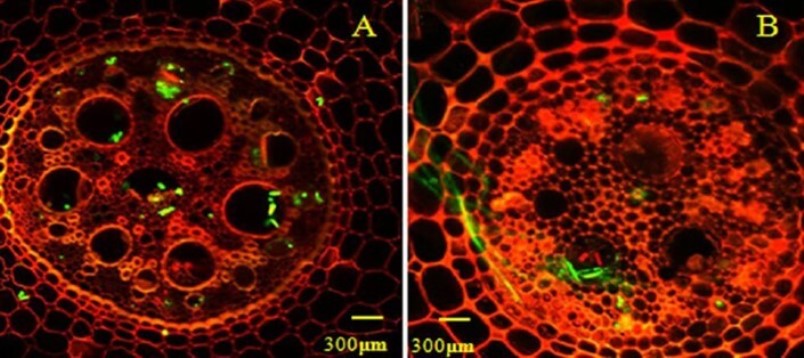
En apariencia el proceso de infección puede ser igual o diferente en plantas susceptibles y resistentes a Foc, dependiendo de las características genéticas de estos materiales (Figura 13).
Durante el proceso de infección de Foc, el hongo secreta enzimas hidrolíticas, incluyendo cutinasas, celulasas y proteasas (Knogge, 1996). Después que el hongo alcanza los conductos de xilema, el patógeno se disemina dentro de la planta, causando daño únicamente a través de la proliferación de hifas y microconidios (Czymmek, 2007) y la producción de fitotoxinas, tal es el caso de ácido fusárico.
Según Li et al. (2017) al estudiar los mecanismos de plantas de banano resistentes a Foc, hay una cantidad numerosa de metabolitos que se activan en respuesta a Foc, especialmente moléculas de transducción de señales. Así la concentración de ABA fue mucho menor en plantas resistentes a Foc, respecto a las susceptibles. El ABA inhibe la expresión de genes de defensa inducidos por el ácido jasmónico y actúa antagónicamente con el ácido salicílico en el proceso de señalización.
Por tanto, la alta concentración de ABA parece estar relacionada con una baja concentración de ácido salicílico y con una baja resistencia a Foc. Adicionalmente, la disminución en la concentración de ácido indolacético (AIA) en plantas susceptibles al patógeno durante el proceso de infección, está asociado a una disminución de la división celular por efecto del prolongado estrés que causa el patógeno.
Li. et al. (2017) observaron que los niveles de algunos genes biosintéticos pueden ser responsables de los cambios en las concentraciones de metabolitos. De esta forma, en la planta resistente a Foc (Musa yunannensis), los altos niveles del gen ICS (isochorismate syn-tetasa) resulta en una alta concentración de ácido salicílico. Por otro lado, la biosíntesis de los genes LOX1.1-3, ACO-1, AOS-1, AOS-3, AOS-4, AOC3-1 y 12-OPR-2, fueron probablemente responsables por la biosíntesis de ácido jasmónico en plantas resistentes, infectadas con Foc. Igualmente se observó una relación directa entre los niveles de expresión en plantas resistentes a Foc de los genes PR y la inducción de ácido salicílico.
|
Figura 12. Las esporas e hifas de Foc TR4 se adhieren a las células del córtex y de los tejidos vasculares de raíces de banano infectadas y susceptibles (B y D) (Musa AAA, Cavendish, ‘BaXi’, ‘BX’) y resistentes (F y H) (M. yunnanensis, ‘YN’). Penetración de esporas e hifas al córtex de las raíces 27 horas después de la infección (b). A las 51 horas después de la infección, una gran cantidad de estructuras del hongo han penetrado la endodermis de los tejidos vasculares. No se observa una aparente diferencia en el proceso de infección del patógeno entre plantas susceptibles y resistentes. Fuente: Li et al., 2017. |
|
Figura 13. Proceso de infección de Foc TR4 en plantas susceptibles (A) Musa AAA, ‘Brazil’ y resistentes (B) Musa AAA, mutante ‘Nongke N° 1’. Presencia de esporas e hifas en la endodermis y tejidos vasculares 27 horas después de la infección (A) y ausentes en B. Fuente: Li et al., 2017. |
En resumen, Li. et al. (2017) observaron que la resistencia a Foc en plantas silvestres de banano (M. yunnanensis), particularmente a la TR4, involucra altos niveles de ácido salicílico y citoquininas, bajos niveles de ácido abscísico (ABA), alta concentración de fenoles y un aumento en la producción de genes (PR) inducidos por el ácido salicílico. Resultados opuestos a los descritos fueron observados en plantas susceptibles a Foc. Las concentraciones de flavonoides y catequinas aumentan en las plantas resistentes en respuesta a la infección con Foc. Finalmente, los autores observaron un aumento de sustancias antioxidantes, como lo son la glutationa y el ácido ascórbico durante el proceso de infección de Foc, tanto en plantas resistentes como susceptibles, pero en mucha mayor magnitud en el caso de individuos resistentes.
Fusarium es un patógeno habitante del suelo que infecta a las plantas a través de las raíces, invadiendo las células epidérmicas de la zona apical y de elongación de las raíces, lo mismo que por medio de heridas, para luego colonizar el sistema vascular, provocando daño en el sistema de movimiento de agua, induciendo marchitez, clorosis del follaje, necrosis de tejidos y muerte de la planta (Pattison et al., 2014).
Una vez que ocurre la infección, se activan las defensas de las plantas. La primera reacción es la respuesta hipersensitiva (HR), la cual causa apoptosis (programación de las células para su muerte) alrededor de las zonas infectadas a efecto de limitar la diseminación de la infección. Los principales agentes que causan apoptosis, son las especies reactivas de oxígeno (ROS), tales como los radicales aniónicos superóxido, los radicales OH-, y el peróxido de hidrógeno (H2O2). Estos radicales libres afectan a las membranas celulares, provocando un daño de sus propiedades selectivas y con ello la pérdida de electrolitos que aceleran la muerte de las células.
Como reacción a la producción de especies reactivas de oxígeno, las plantas producen enzimas barredoras de estas (ROS-scavengers), que neutralizan a los radicales libres y con ello mantienen la homeostasis del sistema. También se producen compuestos antioxidantes, los que actúan mitigando y reparando los daños causados por las ROS. Dentro de estos antioxidantes se incluyen los flavonoides, polifenoles y otros más. Por tanto, la producción de estos antioxidantes es un reflejo de la actividad de defensa de las plantas y a la inducción de la HR, en este caso debido al ataque de un patógeno (Antnony et al., 2017).
|
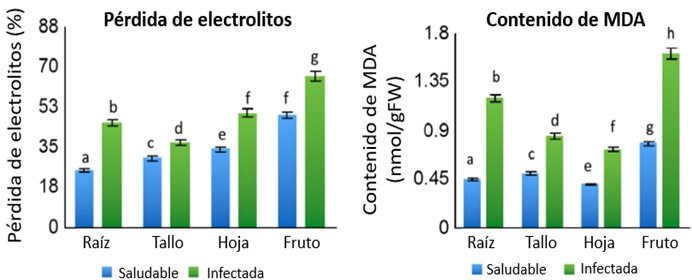
Figura 14. Daño provocado por la infección de Foc en Musa acuminata cv ‘Berangan’ en relación a plantas sanas. Pérdida de electrolitos y contenido de malondialdehido (MDA). Fuente: Anthony et al., 2017. |
Los daños producidos por las ROS pueden ser cuantificados a través de dos mediciones: por la pérdida de electrolitos de las células o bien por medio de la medición del malondialdehido (MDA), que es el mayor producto de la peroxidación de lípidos que ocurre durante el estrés oxidativo. Por tanto, altos contenidos de MDA son indicativos de altos niveles de peroxidación de lípidos por efecto de radicales libres (Antnony et al., 2017).
Según Antnony et al. (2017) al comparar plantas de banano (Musa acuminata cv ‘Berangan’) sanas e inoculadas con Foc, observaron una mayor pérdida de electrolitos y producción de MDA en las plantas infectadas con Foc, respecto a las sanas (Figura 14), lo cual indica el daño provocado por el hongo a la integridad de los tejidos de las plantas.
Anthony et al. (2017) encontraron que la concentración de ROS por efecto de la acción enzimática de peroxidasas, polifenol-oxidasa y lipoxigenasa, fue significativamente mayor en los tejidos de las plantas infectadas con Foc, respecto a las sanas (Figura 15).
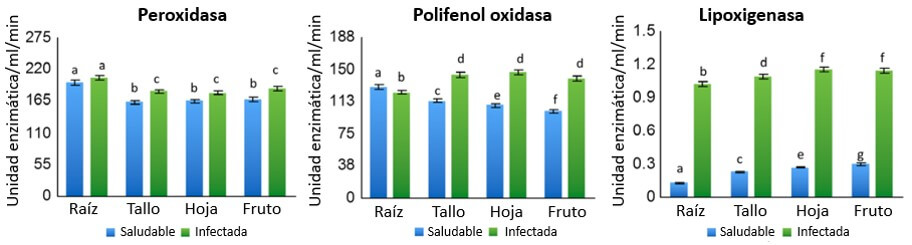
|
Figura 15. Análisis de ROS: actividad de las enzimas peroxidasa, polifenol oxidasa, lipoxigenasa en plantas sanas e inoculadas con Foc en Musa acuminata cv ‘Berangan’. Fuente: Anthony et al., 2017. |
Estas enzimas son sintetizadas como una HR a la acción del patógeno, resultando en la liberación de radicales libres que dañan los tejidos de la planta hasta provocar su muerte. Así la planta limita el desarrollo del patógeno para alcanzar tejidos sanos y continuar con su efecto dañino; sin embargo; esta estrategia de defensa no funciona contra Foc, dado que es un patógeno hemi-biotrófico. Esto significa que parasita tejidos vivos por algún tiempo y continúa viviendo en tejidos muertos.
Desde luego altos niveles de ROS provocan un daño celular irreversible, como consecuencia causan indirectamente, una alta pérdida de electrolitos y formación de MDA, tal como fue discutido previamente.
Las ROS son responsables de causar apoptosis y limitar la expansión de la infección, pero si estos no son regulados, pueden continuar el daño a la planta lo que atenta contra la sobrevivencia de la misma.
Para evitar esto, la planta sintetiza las enzimas ¨barredoras¨ de ROS, las cuales catalizan su transformación a especies no dañinas, como es el caso del agua. La ascorbato peroxidasa (APX) y la guaiacol peroxidasa (PPX), detoxifican al peróxido de hidrógeno utilizando al ascorbato y al guaiacol como substrato, generando agua. La superóxido dismutasa actúa sobre los radicales libres para transformarlos en agua o peróxido de hidrógeno. Este último es menos dañino en relación a los superóxidos.
Anthony et al. (2017) observaron una mayor concentración de sustancias barredoras de especies reactivas de oxígeno en todas las secciones de las plantas de banano inoculadas con Foc, respecto a las plantas sanas (Figura 16). Esto es consistente con la misma tendencia observada para el caso de las ROS. Estas últimas al final, estimulan la acción de las primeras. Para el caso de las catalasas (Figura 16) la tendencia fue inversa a la de las otras enzimas, ya que su concentración fue más baja en plantas enfermas.
Según Antnony et al. (2017) una posible razón para justificar esto, se basa en el hecho de que la regulación de la hipersensitivad (HR) de las plantas está determinada por varios procesos, uno de ellos por la vía del ácido salicílico. Así cuando este es inducido en respuesta al daño de Foc, algunos derivados del ácido salicílico se enlazan con la enzima catalasa (CAT), inhibiendo la acción enzimática de esta. Consecuentemente, se acumula peróxido de hidrógeno, el cual puede actuar como un agente que combate al patógeno, pero a su vez estimula la acción de las ROS, según lo indicado.
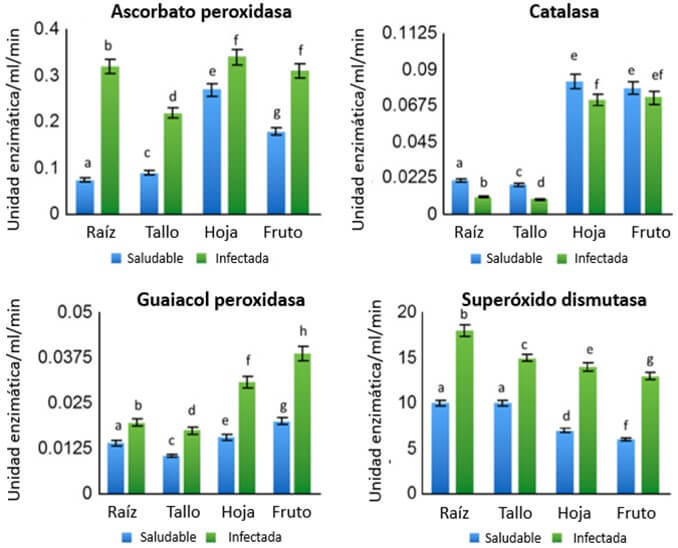
|
Figura 16. Análisis de sustancias “barredoras” de ROS: actividad de la ascorbato peroxidasa, catalasa, guaiacol peroxidasa y superóxido dismutasa en plantas sanas e inoculadas con Foc en Musa acuminata cv ‘Berangan’. Fuente: Anthony et al., 2017. |
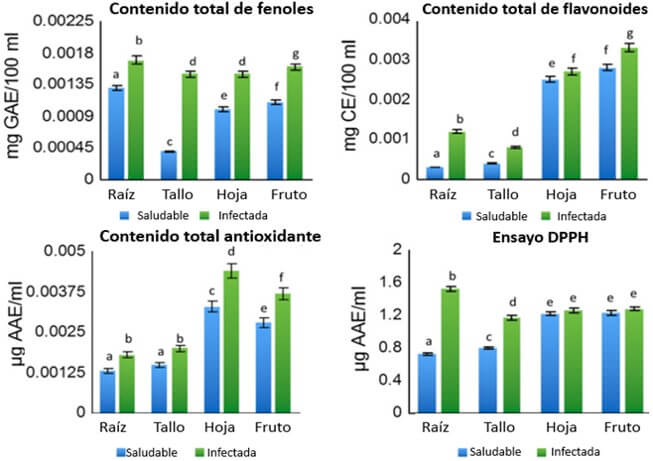
|
Figura 17. Análisis de antioxidantes: contenido total de fenoles, flavonoides, capacidad total de antioxidantes y actividad neutralizante del DPPH en plantas sanas e inoculadas con Foc en Musa acuminata cv ‘Berangan’. Fuente: Anthony et al., 2017. |
Anthony et al. (2017) encontraron una mayor concentración de antioxidantes en las plantas infectadas con Foc, respecto a las plantas sanas de banano, mostrando los cuatro tipos evaluados la misma tendencia (Figura 17).
Los antioxidantes son compuestos bioquímicos producidos por las plantas y tienen dos roles importantes. Primero, inhiben la oxidación de los lípidos que es catalizada por radicales libres y segundo, reducen los agentes oxidantes, es decir convertir radicales libres en moléculas estables. Por ello en presencia de radicales libres se induce también la de antioxidantes.
Las plantas son productoras naturales de compuestos fenólicos, uno de los más importantes son las fitoalexinas. Las fitoalexinas son agentes antimicrobianos y compuestos antioxidantes que se acumulan como respuesta a la infección de un patógeno (Ahuja et al., 2012). Por tanto la infección por Foc conduce a la acumulación de fitoalexinas, que causan un aumento de la cantidad total de polifenoles libres (TPC) en las plantas infectadas.
Los flavonoides son compuestos del metabolismo secundario, con una amplia distribución en las plantas y algunos de ellos han sido encontrados como agentes inhibitorios de las infecciones por patógenos. La capacidad antioxidante de los flavonoides se debe a su habilidad de secuestrar radicales libres y así bloquean su acción catalítica. Por tanto al incrementarse la concentración de especies reactivas de oxígeno, también aumentan la de cantidad total de flavonoides libres (TFC) y con ello se reduce el potencial de daño de los ROS sobre la integridad de las células.
Conclusiones
- Foc es un hongo muy persistente en el suelo en forma de clamidosporas, las que en contacto con las raíces del banano u otra especie sensibles, germinan y sus hifas se adhieren a las células epidérmicas de las raíces en sus zonas apicales y de elongación, pero que también pueden penetrar raíces dañadas.
- Por acción de enzimas degradativas, destruyen las paredes celulares y tejidos del córtex y avanza hasta alcanzar la endodermis y los tejidos vasculares.
- El proceso de infeccción es bastante rápido, pero la colonización de la zona vascular es lenta. Esta colonización se realiza por medio de hifas y microconidios del hongo.
- Una vez que el patógeno invade el sistema vascular de las raíces y del pseudotallo, puede ocurrir una obstrucción de los tejidos conductores de agua, lo cual se produce por la acumulación de geles, gomas y tilosas.
- Un segundo mecanismo de daño, consiste en la producción por parte del hongo de micotoxinas, tal es el caso del ácido fusárico y la beauvericina. Estas sustancias, aún en bajas concentracciones, tienen la capacidad de destruir las células y producir necrosamientos a los tejidos, lo típico de la infección por Foc.
- La patogenisidad de diversos aislamientos de Foc está directamente correlacionada con la capacidad de estos de producir tanto ácido fusárico como beauvericina.
- De acuerdo con Liu et al. (2019) Foc TR4 puede emplear una variedad de estrategias para acelerar la infección. Estas incluyen la secreción de ácido fusárico, que puede difundirse antes que el patógeno y comprometer la inmunidad del huésped, al perturbar la respiración e inducir la producción de ROS mitocondriales, la hipersensibilidad inducida por toxinas o la muerte celular. Estos cambios facilitan la invasión de Foc desde la raíz hacia el xilema y ayudan al desarrollo de los síntomas como marchitez vascular y pudrición de la raíz en el banano.
- El ácido fusárico de Foc TR4 funciona como un factor de virulencia positivo y actúa en la etapa temprana del desarrollo de la enfermedad antes de la aparición de las hifas del hongo en los tejidos infectados (Liu et al.2019)
- No está claro si el proceso de invasión de los tejidos vasculares en plantas resistentes o sensibles a Foc es diferente o no. Algunos trabajos no muestran una diferencia, pero en otros la cantidad de hifas y macroconidios son siempre mayores en plantas susceptibles al hongo.
- Foc causa una clorosis de las hojas, particularmente de las basales a las apicales, por efecto de la acción de las fitotoxinas o bien por el taponamiento de los conductos vasculares de la nervadura central por acción directa del patógeno.
- El daño de Foc, causa un cierre estomático y una marchitez, lo que a su vez provoca una aumento de la temperatura de las hojas, justamente por la pérdida del poder de enfriamiento que induce la transpiración.
- En las hojas con daño por Foc hay una rápida caída en la tasa de fotosíntesis neta.
- Los mecanismos de resistencia a Foc involucran la síntesis de varios metabolitos. La concentración de ABA (ácido abscísico) es baja en plantas resistentes, ya que este compuesto inhibe la expresión de los genes de resistencia y actúa antagónicamente con el ácido salicílico. En plantas susceptibles, por otro lado, la concentración de ABA es mayor.
- En plantas resistentes a Foc, hay una inducción de la expresión de genes de resistencia, que activan procesos de defensa en la planta por medio de una mayor producción de ácido salicílico y ácido jasmónico. Ambas sustancias muy activas en los procesos de defensa de la planta contra agentes patogénicos.
- También en plantas resistentes a Foc, hay una mayor concentración de fenoles y sustancias antioxidantes.
- La infección por Foc, activa mecanismos de hipersensibilidad de la planta que conducen la síntesis de especies reactivas de oxígeno (ROS).
- Las ROS provocan un daño irreversible en las membranas celulares que condiciona a la muerte de las mismas (apoptosis) para limitar la expansión de Foc a tejidos sanos; sin embargo Foc es un patógeno hemi-biotrófico, que puede sobrevivir en tejidos muertos.
- En respuesta a la producción de ROS, las plantas infectadas con el patógeno reaccionan produciendo enzimas que convierten a los superóxidos y radicales OH- en compuestos estables no dañinos a las células.
- En adición, las plantas con infección de Foc, producen concentraciones mayores de sustancias antioxidantes que inhiben la oxidación de los lípidos (por acción de las ROS), además transforman a las ROS en sustancias estables para mantener la homeostasis del sistema. Los más conocido antioxidantes, pero no únicos, son la fitolalexinas.
Cita correcta de este artículo
Segura, M. A. 2019. ¿Cómo Fusarium oxysporum f. sp. cubense (Foc), daña los tejidos del banano y qué mecanismos de defensa existen en las plantas resistentes para evitarlo?. Serie Frutales, Núm. 58. Artículos técnicos de INTAGRI. México. 17 p.
Literatura citada
- Berestetskiy. 2008. A review of fungal phytotoxins: from basic studies to practical use, Appl. Biochem. Microbiol. 44:453-465.
- A. Di Pietro.2003. Fusarium oxysporum: exploring the molecular arsenal of a vascular wilt fungus, Mol. Plant Pathol. 4:315-325.
- A.F. Krivanek, J.F. Stevenson, M.A. Walker. 2005. Development and comparison of symptom indices for quantifying grapevine resistance to Pierce’s disease, Phytopapatology. 95(1):36-43. doi: 10.1094/PHYTO-95-0036
- Anthony, KK; George, DS; Kaur, H; Singh, B; Fung, SM. 2017. Reactive Oxygen Species Activity and Antioxidant Properties of Fusarium Infected Bananas. Journal of Plant Phytopathology 165:213–222. DOI: https://doi.org/10.1111/jph.12552.
- Beckman, C. H. 1990. Host responses to the pathogen. Pages 93-105 in: Fusarium Wilt of Banana. R. C. Ploetz, ed. American Phytopathological Society, St. Paul, MN.
- C.B. Michielse.2009. M. Rep, Pathogen profile update: Fusarium oxysporum, Mol. Plant Pathol. 10:311-324.
- Czymmek KJ (2007) In vivo time-lapse documentation using confocal and multi-photon microscopy reveals the mechanisms of invasion into the Arabidopsis root vascular system by Fusarium.
- de Ascensao, A. R. F. D. C., and Dubery, I. A. 2003. Soluble and wall-bound phenolics and phenolic polymers in Musa acuminata roots exposed to elicitors from Fusarium oxysporum f. sp. cubense. Phytochemistry 63:679-686.
- Dong, X; Ling, N; Wang, M; Shen, Q; Guo, S. 2012. Plant Physiology and Biochemistry Fusaric acid is a crucial factor in the disturbance of leaf water imbalance in Fusarium -infected banana plants (en línea). Plant Physiology et Biochemistry 60:171–179. DOI: https://doi.org/10.1016/j.plaphy.2012.08.004.
- Dong, X; Xiong, Y; Ling, N; Shen, Q; Guo, S. 2014. Fusaric acid accelerates the senescence of leaf in banana when infected by Fusarium. World Journal of Microbiology and Biotechnology. DOI: https://doi.org/10.1007/s11274-013-1564-1.
- H. Toyoda. 1988. Detoxification of fusaric acid by a fusaric acid-resistant mutant of Pseudomonas solanacearum and its application to biological control of Fusarium wilt of tomato, Phytopathology 78:1307-1311.
- I. Gapillout.1996. Effects of fusaric acid on cells from tomato cultivars resistant or susceptible to Fusarium oxysporum f. sp. Lycopersici, Eur. J. Plant Pathol. 102:127-132.
- K.J. Czymmek. 2007.In vivo time-lapse documentation using confocal and multi- photon microscopy reveals the mechanisms of invasion into the Arabidopsis root vascular system by Fusarium oxysporum, Fungal Genet. Biol. 44: 1011-1023.
- Knogge W (1996) Fungal infection of plants. Plant Cell 8(10):1711.
- Li, C; Bioscience, T; Academy, C. 2017. Direct Root Penetration and Rhizome Vascular Colonization by Fusarium oxysporum f. sp. cubense are the Key Steps in the Successful Infection of Brazil Cavendish. (July):2073–2078. DOI: https://doi.org/10.1094 /PDIS-04-17-0467-RE.
- Li, C; Zuo, C; Deng, G; Kuang, R; Yang, Q; Hu, C; Sheng, O; Zhang, S; Ma, L; Wei, Y; Yang, J; Liu, S; Biswas, MK; Viljoen, A; Yi, G. 2013. Contamination of Bananas with Beauvericin and Fusaric Acid Produced by Fusarium oxysporum f. sp. cubense. PLoS ONE 8(7). DOI: https://doi.org/10.1371/journal.pone.0070226. 1-11.
- Li, W; Li, C; Li, S; Peng, M. 2017. Long noncoding RNAs that respond to Fusarium oxysporum infection in ‘Cavendish ’ banana (Musa acuminata . Scientific Reports (June):1–13. DOI: https://doi.org/10.1038/s41598-017-17179-3.
- Li, W; Li, C; Sun, J; Peng, M; Resources, G. 2017. Metabolomic, Biochemical, and Gene Expression Analyses Reveal the Underlying Responses of Resistant and Susceptible Banana Species during Early Infection with Fusarium oxysporum f. sp. cubense. Plant Disease. 101:534-543 • http://dx.doi.org/10.1094/PDIS-09-16-1245-RE.
- Liu, Y; Zhu, A; Tan, H; Cao, L; Zhang, R. 2019. Engineering banana endosphere microbiome to improve Fusarium wilt resistance in banana. Microbiome. 7:74 https://doi.org/10.1186/s40168-019-0690-x:1–15.
- Pattison AB, Wright CL, Kukulies TL, Molina AB. 2014. Ground cover management alters development of Fusar- ium wilt symptoms in Ducasse bananas. Australas Plant Path 43:465–476.
- Ploetz RC.2006. Fusarium wilt of banana is caused by several pathogens referred to as Fusarium oxysporum f. sp. cubense. Phytopathology 96: 653–656.
- Ploetz, R. C. 2015. Fusarium wilt of banana. Phytopathology 105:1512.
- R. Mepsted, J. Flood, R.M. Cooper. 1995. Fusarium wilt of oil palm II. Stunting as a mechanism to reduce water stress, Physiol. Mol. Plant Pathol. 46:373-387.
- S. Pivonia, R. Cohen, J. Katan, J. Kigel. 2002. Effect of fruit load on the water balance of melon plants infected with Monosporascus cannonballus, Physiol. Mol. Plant Pathol. 60: 39-49.
- S.E. Scheckler, J. Galtier.2003.Tyloses and ecophysiology of the early carboniferous progymnospermtree Protopitysbuchiana, Ann.Bot.-London.91:739-747.
- Sun, Y; Yi, X; Peng, M; Zeng, H; Wang, D; Li, B; Tong, Z. 2014. Proteomics of Fusarium oxysporum Race 1 and Race 4 Reveals Enzymes Involved in Carbohydrate Metabolism and Ion Transport That Might Play Important Roles in Banana Fusarium Wilt. PLOS ONE | DOI:10.1371/journal.pone.0113818. December 2:1–20. DOI: https://doi.org/10.1371/journal.pone.0113818.
- van den Berg, N., Berger, D. K., Hein, I., Birch, P. R. J., Wingfield, M. J., and Viljoen, A. 2007. Tolerance in banana to Fusarium wilt is associated with early up-regulation of cell wall-strengthening genes in the roots. Mol. Plant Pathol.
- Warman, NM; Aitken, EAB; Dita, M; Grant, M. 2018. The Movement of Fusarium oxysporum f. sp. cubense (Sub-Tropical Race 4) in Susceptible Cultivars of Banana. Frontiers in Plant Science 9:1–9. DOI: https://doi.org/10.3389/fpls.2018.01748.




it is a great site.
Thank you. You help us with your visits to continue improving.