Autores: Carlos Alberto Garza Alonso, Emilio Olivares Sáenz, Adriana Gutiérrez Díez,
Rigoberto E. Vázquez Alvarado y Alfredo López Jiménez
Introducción
La higuera (Ficus carica L.) es una de las especies del género Ficus ampliamente distribuida alrededor del mundo, con frutos comestibles apreciados por las características organolépticas y alto valor comercial. Los higos son ricos en carbohidratos, minerales, compuestos bioactivos, entre otras propiedades. Además, algunos compuestos pueden ser encontrados en las hojas (USDA, 2019). Varios estudios sugieren que las hojas de higuera tienen la capacidad de disminuir los niveles de azúcar en la sangre, así como la disminución del colesterol total y el aumento de los niveles de antioxidantes (Deepa et al., 2018).
A nivel mundial, la superficie cosechada y el volumen de producción de higo se ha mantenido constante en los últimos años, donde los principales productores de higo son Turquía, Egipto, Marruecos, Argelia e Irán (FAO, 2019). En algunos países como México, el cultivo de higuera ha mostrado una tendencia al alza, con una tasa de crecimiento anual promedio de 6% para la superficie cosechada y de un 13% en el volumen de producción (FAO, 2019). La superficie cosechada en México en el año 2017 fue de 1440 ha, con un rendimiento promedio de 5.6 ton/ha (SIAP, 2019). Sin embargo, bajo condiciones de invernadero, se han reportado rendimientos superiores a 100 ton/ha (Mendoza et al., 2017).
Existen diversos factores físicos, químicos y biológicos que pueden influir en el desarrollo de los cultivos, entre ellos la nutrición vegetal. Los nutrimentos cumplen un papel esencial y específico en las plantas. Cuando uno de estos elementos no se encuentra en las cantidades adecuadas, su deficiencia en los tejidos promueve cambios en el metabolismo de la planta, afectando el crecimiento vegetativo. Por medio de la técnica del elemento faltante es posible estudiar el efecto de la ausencia de algún elemento. Dicho método consiste en preparar una solución nutritiva completa sin agregar el elemento que se requiere analizar (Kathpalia y Bhatla, 2018). A nivel mundial se han realizado numerosos trabajos sobre deficiencias nutrimentales en cultivos como cereales, hortalizas y frutales, así como en plantas de importancia forestal y ornamental (Alves et al., 2016; Alves et al., 2015; Chen et al., 2010; Dussán et al., 2016; Mota et al., 2014) donde se han encontrado diferencias significativas en la respuesta a las deficiencias nutrimentales.
A nivel mundial se han realizado pocos trabajos de investigación sobre la nutrición de la higuera. Algunos experimentos se han basado en los efectos de los elementos esenciales en la planta, pero se habla poco sobre las deficiencias nutrimentales de éstas y su relación con el crecimiento vegetativo, vigor, producción y calidad de frutos. Además, se desconocen los síntomas visuales de deficiencia de algunos elementos. Con base en lo anterior, en la presente investigación se estudiaron los efectos de las deficiencias nutrimentales sobre algunas variables de crecimiento vegetativo de la higuera, así como en la producción de frutos y síntomas visuales en hojas.
Materiales y métodos
Establecimiento del experimento
La presente investigación se realizó en la Facultad de Agronomía de la Universidad Autónoma de Nuevo León (UANL), con una ubicación geográfica de 25° 47´ 07´´ latitud Norte, 100° 17´ 03´´ longitud Oeste, con una altitud de 479 msnm (INEGI, 2019). El clima de la región se considera semiárido, con una precipitación de 550 mm y una temperatura media anual de 23 °C (SMN, 2019). El experimento se llevó a cabo bajo condiciones controladas en un invernadero tipo gótico, con una superficie de 1,000 m2 y altura a la canaleta aproximada de 4.5 m y su parte más alta de 7 m. Durante el período de estudio, la temperatura promedio y la humedad relativa del invernadero fueron de 25 ° C y 70%, respectivamente. Para inducir las deficiencias nutrimentales en las plantas, se utilizó la técnica del elemento faltante, que consistió en preparar soluciones nutritivas completas carentes del elemento que se pretende observar sus efectos (Kathpalia y Bhatla, 2018). El sustrato utilizado fue perlita, material inerte con un pH neutro y sin contenido de nutrimentos minerales (Papadopoulos et al., 2008). Las plantas utilizadas corresponden a la variedad “Adriatic”, las cuales fueron proporcionadas por el vivero de plantas nativas de la Facultad de Agronomía – UANL; tenían 6 meses y una altura promedio de 20 cm.
Se utilizaron macetas de 19 L con una planta cada una, tutoradas a un solo tallo. Antes de colocar las plantas, se realizó un lavado del sistema radicular con agua destilada para eliminar los restos de suelo, sustrato y otras impurezas. El riego se suministró de manera automática mediante el uso de temporizadores, aplicando 8 pulsos diarios de 60 ml cada uno por maceta, utilizando contenedores de 50 L con las soluciones nutritivas de cada tratamiento. El experimento se estableció el 10 de septiembre del 2018, llevando a cabo el acopio de datos del 24 de septiembre del mismo año al 22 de abril del 2019.
Tratamientos
Los tratamientos evaluados en la presente investigación fueron: T1-Solución nutritiva completa (control); T2-Solución sin nitrógeno (-N); T3-Solución sin fósforo (-P); T4-Solución sin potasio (-K); T5-Solución sin calcio (-Ca) y T6-Solución sin magnesio (-Mg). Para evaluar los tratamientos se empleó un diseño completamente al azar con 4 repeticiones. Para la preparación de las soluciones nutritivas se seleccionó la solución propuesta por Hewitt (Cuadro 1), la cual fue evaluada en higuera por Sevil et al. (2007) bajo condiciones ambientales similares, encontrando buenos resultados. Para mantener el equilibrio iónico en la solución nutritiva, en los tratamientos para la deficiencia de macronutrimentos, se calculó utilizando diferentes concentraciones de sales minerales para equilibrar la suma de aniones y cationes en las soluciones nutritivas. Las fuentes de fertilizante fueron: KNO3, KH2PO4, MgSO4, Ca (NO3)2, K2SO4, CaSO4, NH4H2PO4, NH4NO3, H3PO4 y HNO3. El pH final de la solución nutritiva fue de 6.5. Los micronutrimentos Fe, Mn, B, Cu, Zn y Mo se suministraron en forma quelatada utilizando el producto comercial Ultrasol® micromix (SQM, Chile). Las formas quelatadas fueron DTPA para Fe, EDTA para Mn, Zn y Cu; B y Mo se aplicaron como sales inorgánicas.
El agua utilizada para la preparación de las soluciones nutritivas tenía una conductividad eléctrica de 0.05 dS/m. El agua fue analizada químicamente, sin encontrarse minerales que afectaran la investigación.
|
Cuadro 1. Solución nutritiva utilizada en el experimento. |
|||
|
Macronutrimentos |
Micronutrimentos |
||
|
Elemento |
mmol/L |
Elemento |
mg/L |
|
N |
12 |
Fe |
2.8 |
|
P |
1.3 |
Mn |
0.55 |
|
K |
4 |
B |
0.54 |
|
Ca |
4 |
Cu |
0.064 |
|
Mg |
1.5 |
Zn |
0.065 |
|
S |
1.5 |
Mo |
0048 |
Síntomas visuales de deficiencias de macronutrimentos
Para la identificación y caracterización de los síntomas visuales de deficiencias de macronutrimentos, se utilizaron las cartas de color para tejidos vegetales de Munsell (Munsell Color, Estados Unidos) para identificar los colores específicos en el caso de clorosis y necrosis de los tejidos.
Evaluación del crecimiento vegetativo
Los datos de crecimiento vegetativo se tomaron en intervalos semanales, realizando las lecturas a la misma hora del día. Las variables evaluadas fueron las siguientes:
- Número de hojas: Se realizó un recuento de las hojas completamente expandidas.
- Elongación del tallo: Para tomar esta medida se utilizó la metodología propuesta por Muñoz (2009), la cual consiste en marcar la rafia de tutoreo en diferentes intervalos de tiempo y medir el crecimiento.
- Distancia de entrenudos: Se obtuvo la distancia de cada entrenudo de la planta y se calculó la media.
- Área foliar: Para esta variable, se midió el ancho de la hoja en su parte más amplia. Con los datos obtenidos, se estimó el área foliar utilizando el modelo de regresión propuesto por Giaccone et al. (2017) para el cultivo de la higuera, aplicándolo en cada hoja y realizando la sumatoria para obtener el área foliar total de la planta.
- Diámetro del tallo: Esta variable se midió directamente usando un vernier digital. Se marcó la parte del tallo para tomar las lecturas en el mismo punto, es decir, a 30 cm de la base.
Al final del experimento, se determinaron las siguientes variables:
- Contenido relativo de clorofila. El contenido relativo de clorofila expresado en unidades SPAD se midió utilizando el equipo portátil SPAD-502 de Minolta (Konica Minolta, Osaka, Japón). Las unidades SPAD se midieron en tres estratos de la planta (estrato bajo: primeras hojas desde la base del tallo; estrato medio: hojas en la zona media del tallo; estrato alto: hojas de la parte más alta del tallo).
- Peso seco. Se determinó el peso seco de la planta, considerando raíz, tallo y hojas. Las muestras se colocaron en un horno de secado Yamato modelo DX602C (Yamato Scientific America, Santa Clara, CA, EE. UU.) a una temperatura de 60 °C por tres días. La materia resultante se pesó en una báscula digital.
- Concentración mineral de raíz, tallo y hojas (detalles en determinación de minerales).
Determinación de minerales
Las concentraciones de nitrógeno (N), fósforo (P), potasio (K), calcio (Ca), magnesio (Mg), fierro (Fe), boro (B), manganeso (Mn), zinc (Zn) y cobre (Cu) fueron determinados en raíz, tallo y hojas. Las muestras secas (0.5 g) se trituraron para someterse a una digestión ácida en una mezcla de HNO3: HClO4 (2:1 mL) y 2 mL de H2O2 al 30%, según la metodología propuesta por Alcantar y Sandoval (1999). El N se cuantificó mediante el método micro-Kjeldahl de acuerdo con la metodología de Bremmer (1965). Las concentraciones de P, K, Ca, Mg, Fe, B, Mn, Zn y Cu se determinaron utilizando un espectrómetro de emisión atómica de inducción de plasma acoplado (ICP-AES) Agilent modelo 725-ES (Agilent Technologies, Santa Clara, CA, EE. UU.).
Análisis estadístico
Los datos de crecimiento se analizaron mediante un diseño completamente al azar con cuatro repeticiones (n= 4). La comparación de medias se realizó por el método de Tukey (P<0.05). Con respecto al análisis estadístico del número de hojas y área foliar, los datos se dividieron en dos períodos de tiempo: del 8 de octubre al 3 de diciembre de 2018 (Período 1), y del 25 de febrero al 22 de abril de 2019 (Período 2), correspondientes al principio y final del experimento, con el objetivo de observar los efectos de la deficiencia nutrimental sobre la senescencia foliar a lo largo del tiempo. Para el análisis de nutrimentos en raíz, tallo y hoja, se consideró el diseño experimental mencionado anteriormente, utilizando tres repeticiones (n= 3). Todos los análisis estadísticos se realizaron con el software SPSS Statistics 21 (IBM Corp., Armonk, NY, EE. UU.)
Resultados y discusión
Síntomas visuales de las deficiencias de macronutrimentos
Deficiencia de N. Se observó la deficiencia de N a los 75 días después del establecimiento del experimento, en las hojas maduras de la parte inferior del tallo. Los síntomas iniciaron con una clorosis en el borde del lóbulo central izquierdo de la hoja, que se extendió a lo largo del mismo y avanzó hacia la nervadura central. Después de unos días, se observó el mismo comportamiento en el lóbulo central derecho de la hoja, acelerando la senescencia de la hoja; en algunos casos, se produjo clorosis total y desprendimiento. La clorosis observada corresponde al color 5 Y 8/8 de las cartas de Munsell para tejidos vegetales (Figura 1B).
Deficiencia de P. Los síntomas se observaron a los 120 días después del establecimiento del experimento. La deficiencia de P inició con una coloración verde intensa en hojas maduras, similar al color 7.5 GY 3/4 de las cartas de Munsell para tejidos vegetales. Posteriormente, se observaron secciones cloróticas en las mismas hojas, sin seguir un patrón definido, como en el caso de N. Esta clorosis progresó gradualmente con el tiempo hasta la necrosis, comenzando en el lóbulo central y, en menor medida, en los lóbulos medios derecho e izquierdo. Al igual que N, P es un elemento móvil en la planta, por lo que los síntomas de deficiencia se presentaron en hojas maduras (Figura 1C).

|
Figura 1. Síntomas visuales de deficiencia de macronutrimentos en hojas de higuera. (A) Testigo o Control; (B) Deficiencia de N; (C) Deficiencia de P; (D) Deficiencia de K; (E) Deficiencia de Ca; (F) Deficiencia de Mg. Fuente: Garza et al., 2019. |
Deficiencia de Ca. La deficiencia de Ca se presentó a los 113 días después del establecimiento del experimento. A diferencia de N, P y K, Ca es un elemento no móvil en la planta; por lo tanto, los síntomas de deficiencia ocurren en hojas nuevas. En este trabajo, la deficiencia de Ca se observó cómo clorosis general en las hojas más jóvenes, similar al color 5 Y 8/8 de las cartas de Munsell para tejidos vegetales. Además, se encontró una marcada deformidad de los lóbulos de la hoja, en comparación con el tratamiento con solución completa. Agustí (2010) menciona que la deficiencia de calcio se presenta como deformidad de las hojas nuevas (Figura 1E).
Deficiencia de Mg. Se observó la deficiencia de Mg a los 94 días después del establecimiento del experimento. El Mg, al igual que N, P y K, es un elemento móvil en la planta, por lo que los síntomas de deficiencia aparecieron primero en hojas maduras. En comparación con N, en la presente investigación, la deficiencia de Mg no apareció inicialmente en la hoja de la parte más baja de la planta, sino en la tercera y cuarta hoja madura desde la base del tallo. La deficiencia de Mg apareció como clorosis intervenal, y se manifestó inicialmente en la parte central de los lóbulos laterales, observándose como una banda verde cerca a las nervaduras de los lóbulos, para después extenderse entre las nervaduras secundarias. Esta clorosis corresponde al color 2.5 GY 8/8-8/10 de las cartas de Munsell para tejidos vegetales. Las nervaduras conservaron el color verde desde la base de la hoja hasta los ápices de cada uno de los lóbulos. Estos síntomas han sido descritos en otros cultivos (Figura 1F). La deficiencia de K en etapas avanzadas puede confundirse con la deficiencia de Mg. Sin embargo, cuando existe una deficiencia de Mg, las nervaduras permanecen completamente verdes en el área del pecíolo hasta los ápices de cada uno de los lóbulos. En el caso de K, todos los márgenes de la hoja presentarán clorosis, incluida la sección de las nervaduras que atraviesan ese borde.
Crecimiento vegetativo
El análisis de varianza registró una diferencia significativa (P<0.05) entre los tratamientos para todas las variables evaluadas. El nitrógeno fue el elemento que más afectó el crecimiento de las plantas de higuera, con los valores más bajos en elongación y diámetro del tallo, altura de la planta y longitud de entrenudos, así como valores más bajos en el peso seco de raíz, tallo y hojas (Cuadro 2).
El nitrógeno es el mineral que se encuentra en mayores cantidades en los tejidos vegetales; es aproximadamente del 1 al 5% de la materia seca total de la planta. Cumple funciones importantes como constituyente de proteínas, ácidos nucleicos, clorofila, coenzimas, fitohormonas y metabolitos secundarios (Hawkesford et al., 2012). Lo anterior explica los resultados encontrados en la presente investigación. En la mayoría de los cultivos, la deficiencia de N causa un crecimiento reducido de las plantas (Alves et al., 2016; Alves et al., 2015; Chen et al., 2010; Dussán et al., 2016; Mota et al., 2014).
|
Cuadro 2. Crecimiento vegetativo de plantas de higuera (Ficus carica L.) bajo deficiencias de macronutrimentos. |
|||||||
|
Tratamiento |
E. T. (cm/semana) |
A. P. (cm) |
D. T. (mm) |
L. E. (cm) |
Peso Seco |
||
|
Raíces |
Tallo |
Hojas |
|||||
|
Control |
6.47 a |
102.42 ab |
13.72 b |
3.34 a |
121.11 a |
114.16 a |
87.46 a |
|
-N |
1.15 b |
35.08 d |
8.40 d |
1.39 c |
27.47 c |
23.03 b |
10.93 c |
|
-P |
4.05 ab |
74.88 c |
11.81 c |
2.64 ab |
66.27 bc |
70.00 ab |
53.56 b |
|
-K |
5.70 a |
96.84 b |
12.58 c |
3.19 ab |
44.37 bc |
109.93 a |
55.20 b |
|
-Ca |
3.28 ab |
69.31 c |
11.63 c |
2.30 bc |
54.47 bc |
66.93 ab |
36.10 bc |
|
-Mg |
5.64 a |
111.01 a |
14.94 a |
3.37 a |
81.14 ab |
70.26 ab |
55.86 b |
E. T.= Elongación de tallo; A. P.=Altura de planta; D. T.= Diámetro de tallo;
L. E.= Longitud de entrenudos
Letras diferentes en cada columna indican diferencias significativas (p<0.05) n=4
Seguidos del N, las deficiencias de P y Ca afectaron por igual el crecimiento vegetativo de todas las variables evaluadas (Cuadro 2). El P es un componente importante de ácidos nucleicos, nucleótidos y fosfolípidos, y una parte importante de ATP; mientras que Ca es un elemento importante para la formación de la pared y membrana celular, cofactor de varias enzimas involucradas en la hidrólisis de ATP y fosfolípidos, así como un mensajero secundario en la regulación metabólica de las plantas (Taiz et al., 2014; Mengel y Kirkby, 2001). El Ca es un elemento importante para la elongación y la división celular, es mensajero secundario, activador de enzimas y desarrollo de los meristemos, de acuerdo con Karthika et al. (2018). Lo anterior explica los efectos de la deficiencia de este elemento en el crecimiento vegetativo de la planta.
En cuanto a la deficiencia de K, el análisis de varianza no encontró diferencias significativas con respecto a la solución nutritiva completa en este período de estudio para las variables de elongación del tallo, altura de planta y longitud de entrenudos. Sin embargo, el K afectó el diámetro del tallo, así como el peso seco de raíces y hojas (Cuadro 2). El K tiene una función importante en la regulación de la presión osmótica y la turgencia celular, por lo que la deficiencia de este elemento tiene una influencia negativa en el metabolismo general de la planta (Alcántar et al., 2016).
Con respecto al tratamiento con deficiencia de Mg, el análisis de varianza no encontró diferencias significativas en la mayoría de las variables de crecimiento (Cuadro 2). Romheld (2012) menciona que en las etapas iniciales de la deficiencia nutrimental, las plantas no expresan síntomas visuales o efectos en el crecimiento vegetativo, lo que explicaría por qué no se encontró una diferencia significativa de este tratamiento en comparación con la solución nutritiva completa para el período de estudio.
Por otro lado, la deficiencia de N afectó significativamente el número de hojas y el área foliar durante el período 1. Sin embargo, la deficiencia de N, P, K, Ca y Mg afectaron las variables antes mencionadas en el período 2, mostrando valores inferiores con respecto al testigo o control (Figura 2). Lo anterior se explica debido a la movilización de nutrimentos (N, P, K y Mg) hacia los puntos apicales para asegurar la supervivencia de la planta, causando una reducción en el número de hojas debido a la senescencia de las mismas, causando una menor área foliar. Los tratamientos con deficiencia nutrimental afectaron negativamente el número y el área de la hoja en el siguiente orden: -N> -Ca> -K> -P> -Mg. Aunque en esta investigación el tratamiento -Mg mostró el menor efecto, se observó una disminución en los valores de estas variables con el tiempo. El proceso de senescencia foliar a causa de la deficiencia de Mg fue ampliamente explicado por Tanoi y Kobayashi (2015), que es similar para los otros elementos móviles en la planta, como N, P y K. La deficiencia de P afecta el crecimiento general de las plantas, así como la expansión de las hojas, lo que explica la reducida área foliar de las plantas establecidas bajo este tratamiento (Kartikha et al., 2018).
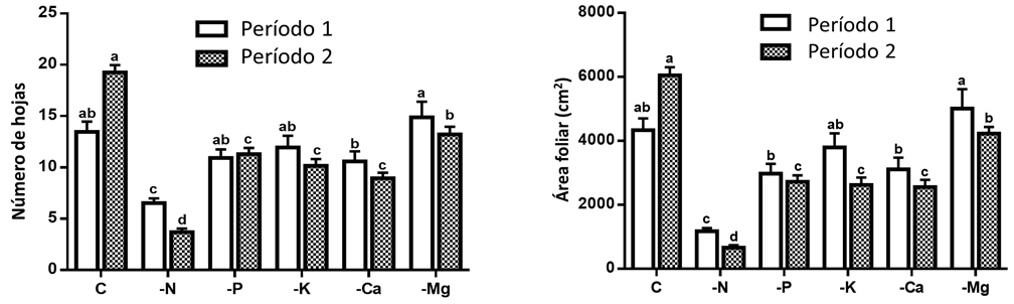
|
Figura 2. Efecto de las deficiencias de macronutrimentos sobre el número de hojas (izquierda) y área foliar (derecha) en dos periodos. Letras diferentes entre las columnas por cada periodo indican diferencia significativa (Tukey, P<0.05). Las líneas sobre las barras indican el error estándar de la media. n=4. Fuente: Garza et al., 2019. |
En cuanto al contenido de clorofila en las hojas, el análisis de varianza identificó diferencias significativas en el estrato bajo de las plantas. El tratamiento con valores más bajos de unidades SPAD fue -K, seguido de -N y -Mg, sin encontrar una diferencia significativa entre -P, -Ca y la solución nutritiva completa. Los bajos contenidos de clorofila en los tratamientos -N, -K y -Mg se explican por la descomposición de los cloroplastos a causa de la degradación de la clorofila y Rubisco durante el proceso de translocación de estos elementos hacia las partes apicales de la planta (Engels et al., 2012). Con respecto al estrato medio de la planta, también se encontraron diferencias significativas, con una tendencia similar al estrato bajo, aunque con valores numéricamente superiores, donde el tratamiento -N resultó con los valores más bajos de unidades SPAD, seguido del tratamiento -Mg. Por otra parte, para el estrato alto, el análisis de varianza no encontró diferencias significativas entre los tratamientos (Figura 3).
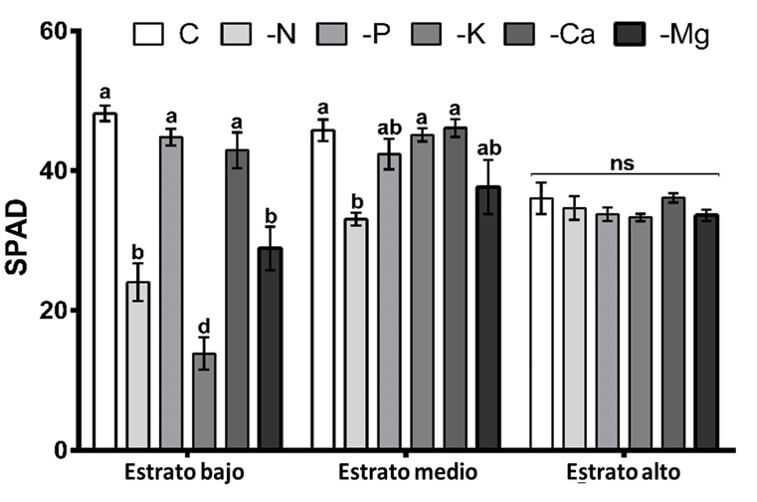
|
Figura 3. Contenido relativo de clorofila, expresado en unidades SPAD en los estratos bajo, medio y alto de las plantas de higuera. Letras diferentes entre las columnas por cada estrato indican diferencia significativa (Tukey, P<0.05). ns, no significativo. Las líneas sobre las barras indican el error estándar de la media. n=4. Fuente: Garza et al., 2019. |
Los resultados del contenido relativo de clorofila coinciden con los reportados en otros experimentos con deficiencias de macronutrimentos en plantas de Capsicum annuum (Soares et al., 2019) y Coffea arabica (Alves et al., 2016).
Concentración de minerales
Los resultados encontrados en el tratamiento completo coinciden con los reportados por Brown (1994) en cuanto a las concentraciones de minerales en higuera, por lo que dichos valores pueden tomarse como referencia para evaluar los efectos de los tratamientos con deficiencia de macronutrimentos. Las concentraciones de N, P, K, Ca y Mg fueron afectadas negativamente en todos los órganos vegetativos para cada uno de sus respectivos tratamientos (-N, -P, -K, -Ca y -Mg), lo cual se esperaba anticipadamente (Cuadro 3).
En el caso del N foliar, no se encontraron diferencias significativas entre la solución nutritiva completa y los tratamientos -P, -K, -Ca y -Mg, presentando la misma tendencia en el caso de la concentración de N en la raíz. Por otro lado, en el tallo se encontró que concentración más alta de N estuvo en el tratamiento -Ca. Además, en este órgano no se encontraron diferencias entre la solución nutritiva completa y los otros tratamientos (Cuadro 3).
|
Cuadro 3. Contenido de N, P, K, Ca y Mg en hoja, tallo y raíz de higuera (Ficus carica L.) con deficiencia de macronutrimentos. |
|||||
|
Tratamiento |
Concentración (%) |
||||
|
N |
P |
K |
Ca |
Mg |
|
|
Hoja |
|||||
|
Control |
2.54 a |
0.16 c |
1.7 a |
2.90 a |
0.48 b |
|
-N |
1.68 b |
0.31 ab |
1.6 a |
2.05 b |
0.32 bc |
|
-P |
2.98 a |
0.22 bc |
1.38 a |
2.17 b |
0.47 b |
|
-K |
2.77 a |
0.32 a |
0.22 b |
2.33 ab |
0.99 a |
|
-Ca |
2.95 a |
0.21 bc |
1.47 a |
2.01 b |
0.49 b |
|
-Mg |
2.67 a |
0.22 bc |
1.62 a |
2.18 b |
0.26 c |
|
Tallo |
|||||
|
Control |
1.65 b |
0.22 a |
0.65 bc |
0.65 ab |
0.25 ab |
|
-N |
0.82 c |
0.27 a |
0.54 cd |
0.68 ab |
0.19 c |
|
-P |
1.30 b |
0.13 b |
0.70 b |
0.71 ab |
0.22 bc |
|
-K |
1.52 b |
0.29 a |
0.26 e |
0.77 a |
0.23 abc |
|
-Ca |
2.18 a |
0.28 a |
0.46 d |
0.56 b |
0.28 a |
|
-Mg |
1.48 b |
0.26 a |
0.84 a |
0.78 a |
0.20 bc |
|
Raíz |
|||||
|
Control |
2.46 ns |
0.51 b |
0.97 ab |
1.43 a |
0.38 a |
|
-N |
1.92 ns |
0.49 b |
0.74 cd |
1.14 ab |
0.25 b |
|
-P |
2.26 ns |
0.23 c |
0.88 bc |
1.41 a |
0.39 a |
|
-K |
2.24 ns |
0.52 b |
0.28 e |
1.17 ab |
0.28 b |
|
-Ca |
2.44 ns |
0.58 b |
0.68 d |
0.65 b |
0.29 b |
|
-Mg |
2.06 ns |
0.86 a |
1.12 a |
1.35 a |
0.22 b |
Letras diferentes entre las columnas por cada parte de la planta indican diferencias significativas (Tukey, P<0.05) n=3.
Para la concentración de P, se observaron valores más altos en el tratamiento con deficiencia de N (Cuadro 3), lo que puede explicarse porque la ausencia del ion NO3- (nitrato) favoreció una mayor absorción y acumulación del ion H2PO4- (fosfato) para mantener el balance de cargas en la planta (Mengel y Kirkby, 2001). Por otro lado, no se encontraron diferencias estadísticamente significativas en el contenido de P en las hojas entre el tratamiento -P y el control; sin embargo, los valores más bajos de este elemento se encontraron en la raíz y el tallo. Lo anterior puede explicarse porque las plantas translocaron el P desde la raíz y el tallo hacia las hojas como un mecanismo para continuar con el crecimiento, pero debido al poco crecimiento vegetativo observado en el tratamiento –P el contenido de ese elemento se acumuló en las hojas, lo que resultó en igualdad estadística con respecto al tratamiento control.
La acumulación de K en las hojas no mostró una diferencia significativa entre los tratamientos -N, -P, -Ca y -Mg, mientras que se encontraron algunas diferencias importantes en el tallo y la raíz, como una mayor acumulación de K en el tratamiento con deficiencia de Mg (Cuadro 3). La interacción de los iones K+ y Mg++ ha sido explicada por varios autores (White, 2012; Farhat et al., 2016 y Guo et al., 2016), y ha sido demostrada en diferentes plantas, como: Cymbopogon citratus (DC.) Stapf. (Lima et al., 2019), Saccharum offcinarum L. (Rhodes et al., 2018), Piper hispidinervum C. DC. (Veígas et al., 2013), Swietenia macrophylla King. . (Veígas et al., 2012) y Heliconia psittacorum L. f. (Ribeiro et al., 2015); lo cual coincide con los resultados encontrados en nuestra investigación. Guo et al. (2016) mencionan que el ion K+ compite con el ion Mg++ por los sitios de unión en el apoplasto, y posiblemente compite por los transportadores; por lo tanto, la alta concentración de K en tallos y raíces en el tratamiento -Mg podría deberse a mayores sitios de unión en el apoplasto y más transportes disponibles.
Por otro lado, la concentración de Ca en las hojas de higuera resultó afectada negativamente en todos los tratamientos con respecto a la solución control, sin encontrar diferencias significativas importantes en tallo y raíz (Cuadro 3). En el caso del Mg, se encontró una concentración más alta en el tratamiento -K (Cuadro 3), lo cual se explica nuevamente con el efecto de la interacción entre K+/Mg++ (White, 2012; Farhat et al., 2016 y Guo et al., 2016). Por otro lado, la concentración de Mg se vio afectada negativamente en el tratamiento -N (Cuadro 3). El Mg forma parte de la molécula de clorofila, al igual que el N (Taiz et al., 2014), lo que explica la disminución de la concentración de Mg al disminuir el contenido de clorofila debido a la ausencia de N.
La concentración de micronutrimentos en el tratamiento control de la presente investigación coincide con los resultados encontrados por Mendoza et al. (2019) y Sun et al., (2017), por lo que dichos valores pueden tomarse como referencia para evaluar los efectos de las deficiencias de macronutrimentos sobre la concentración de micronutrimentos en higuera (Cuadro 4).
En cuanto a las concentraciones de micronutrimentos en los distintos órganos vegetativos de la higuera, el análisis de varianza encontró diferencias significativas en la mayoría de los elementos. En general, se encontraron concentraciones más bajas de Fe, B, Mn, Zn y Cu en el tratamiento -N, lo que puede explicarse por el pobre crecimiento vegetativo de las plantas establecidas con ausencia de este elemento (Cuadro 4).
Mengel y Kirkby (2001) explican que las plantas tienden a acumular mayores cantidades de micronutrimentos cuando hay un mayor crecimiento vegetativo, por lo que cuanto menor es el crecimiento vegetativo, menor es la concentración de elementos. Además, el crecimiento de raíces disminuyó significativamente en el tratamiento con ausencia de N (Cuadro 2), de modo que a un crecimiento radical más bajo, la absorción de micronutrimentos disminuye.
Por otro lado, se encontraron altas concentraciones de Mn en los tratamientos -K y -Ca en todos los órganos vegetativos, así como altos niveles de Fe en el tratamiento -K (Cuadro 4). Lo anterior puede explicarse por el antagonismo de los iones en la rizósfera y el acceso a la planta debido a las cargas de los cationes mencionados anteriormente.
|
Cuadro 4. Contenido de Fe, B, Mn, Zn y Cu en hoja, tallo y raíz de higuera (Ficus carica L.) con deficiencia de macronutrimentos. |
|||||
|
Tratamiento |
Concentración (mg/kg MS) |
||||
|
Fe |
B |
Mn |
Zn |
Cu |
|
|
Hoja |
|||||
|
Control |
914.27 a |
151.54 ab |
148.96 b |
45.15 a |
6.16 ab |
|
-N |
456.52 b |
143.75 ab |
92.59 b |
28.93 b |
4.47 c |
|
-P |
600.61 ab |
105.77 b |
107.93 b |
38.15 ab |
6.85 a |
|
-K |
497.30 b |
111.75 b |
253.49 a |
34.51 ab |
5.17 bc |
|
-Ca |
660.01 ab |
175.41 a |
275.54 a |
43.84 a |
4.80 bc |
|
-Mg |
655.75 a |
126.61 ab |
130.38 b |
36.71 ab |
4.77 bc |
|
Tallo |
|||||
|
Control |
118.19 b |
23.66 ns |
31.85 bc |
9.66 ab |
2.84 cd |
|
-N |
112.96 b |
23.85 ns |
14.04 d |
8.71 b |
4.47 a |
|
-P |
96.15 b |
25.55 ns |
16.32 cd |
12.37 a |
3.73 ab |
|
-K |
205.46 a |
25.39 ns |
65.81 a |
10.84 ab |
4.08 a |
|
-Ca |
156.63 ab |
25.58 ns |
80.50 a |
11.75 ab |
2.30 d |
|
-Mg |
157.97 ab |
29.95 ns |
34.96 b |
9.66 ab |
3.15 bc |
|
Raíz |
|||||
|
Control |
1135.18 ns |
40.70 a |
103.47 cd |
30.09 ns |
18.78 bc |
|
-N |
1377.86 ns |
21.95 b |
56.86 cd |
44.03 ns |
33.45 a |
|
-P |
1061.14 ns |
38.46 a |
39.86 d |
42.83 ns |
27.36 ab |
|
-K |
1434.33 ns |
29.61 ab |
221.87 a |
39.47 ns |
28.26 ab |
|
-Ca |
1263.48 ns |
29.88 ab |
191.40 ab |
47.88 ns |
20.33 bc |
|
-Mg |
890.36 ns |
30.58 ab |
131.91 bc |
34.97 ns |
13.73 c |
Letras diferentes entre las columnas por cada parte de la planta indican diferencias significativas (Tukey, P<0.05) n=3.
Para el caso de Cu, se encontró un aumento significativo en el tallo para los tratamientos -N, -P y -K, con respecto al control (Cuadro 4). Lo anterior se puede atribuir al llamado "efecto de dilución", es decir, que algunos elementos se concentran en mayor cantidad cuando hay menor contenido materia seca (como en el caso de plantas establecidas bajo deficiencia de N, P y K, mientras que las plantas con mayor crecimiento tendrán minerales mejor distribuidos y en menor concentración. Este efecto es ampliamente descrito por Mengel y Kirkby (2001).
Por otro lado, la concentración más alta de Cu en la raíz se encontró en el tratamiento -N (Cuadro 4). De acuerdo con Rodríguez et al. (2016), el ion Cu++ accede a la planta principalmente por flujo de masas, proceso que depende directamente de la transpiración de la planta para favorecer el transporte por xilema y la distribución hacia la parte aérea. Las plantas establecidas bajo deficiencia de N tuvieron un menor crecimiento vegetativo, incluyendo número de hojas y área foliar, lo que ocasiono una menor transpiración y, por lo tanto, una baja movilización de solutos en el xilema. Este efecto condujo a la acumulación de Cu en el sistema de raíces de las plantas. En cuanto a las concentraciones de Zn, no se encontraron diferencias significativamente importantes (Cuadro 4).
Existen pocos estudios sobre el contenido mineral en diferentes partes vegetativas de la higuera en las que se pueden encontrar diferencias en las concentraciones de los elementos antes mencionados en varios cultivares de higuera. ("Calimyrna" (Brown, 1994), "Pellejo duro" (Moreno et al., 1998), "Conadria" (Sun et al., 2017) y "Nezahualcóyotl" (Mendoza et al., 2019), por lo que es difícil seleccionar valores de referencia. Sin embargo, en la mayoría de los casos, se informaron concentraciones de macro y micronutrimentos similares a las encontradas en la presente investigación.
Conclusiones
Las plantas de higuera mostraron síntomas visuales específicos ante la ausencia de cada elemento. El N fue el elemento que más afecto el crecimiento vegetativo de la higuera, seguido de P, K y Ca; Además, N, K y Mg disminuyeron el contenido de clorofila en el estrato bajo de las plantas. La ausencia de algunos elementos ocasionó una mayor acumulación de otros iones en los diferentes tejidos de la planta debido a las interacciones de antagonismo y sinergia que se dan entre ellos.
Cita correcta de este artículo
Garza, A. C. A.; Olivares, S. E.; Gutiérrez, D. A.; Vázquez, A. R. E.; López, J. A. 2020. Deficiencia de Macronutrimentos en Higuera (Ficus carica L.): Síntomas Visuales, Crecimiento Vegetativo y Contenido Mineral. Serie Frutales, Núm. 64. Artículos Técnicos de INTAGRI. México. 16 p.
Referencias
- Agricultural Research Service, United States Department of Agriculture (USDA). Food Composition Databases. Disponible online: https://ndb.nal.usda.gov/ndb/search/list (consultado el 10 de septiembre de 2019).
- Deepa, P.; Sowndhararajan, K.; Kim, S.; Park, S.J. A role of Ficus species in the management of diabetes mellitus: A review. J. Ethnopharmacol. 2018, 215, 210–232.
- Food and Agriculture Organization (FAO). Statistical Yearbook. Agricultural Production. Disponible online: http://www.fao.org/faostat/es/#data/QC (consultado el 12 de septiembre de 2019).
- Servicio de Información Agroalimentaria y Pesquera (SIAP). Disponible online: https://www.gob.mx/siap/acciones-y-programas/produccion-agricola-33119 (Consultado el 10 de septiembre de 2019).
- Mendoza, C.V.M.; Vargas, C.J.M.; Calderón, Z.G.; Mendoza, C.M.C.; Santacruz, V.A. Intensive production systems of Fig (Ficus carica L.) under greenhouse conditions. Exp. Agric. 2017, 3, 339–350.
- Kathpalia, R.; Bhatla, S.C. Plant Mineral Nutrition. In Plant Physiology, Development and Metabolism; Bhatla, S.C., Lal, M.A., Eds.; Springer: Berlin/Heidelberg, Germany, 2018; pp. 37–81.
- Alves, F.R.; Montes, N.B.M.; Almeida, H.; Mello, P.R. Growth and nutritional disorders of coffee cultivated in nutrient solutions with suppressed macronutrients. J. Plant Nutr. 2016, 11, 1578–1588.
- Alves, F.R.; Montes, N.B.M.; Almeida, H.; Mello, P.R. Growth and nutritional disorders of eggplant cultivated in nutrients solutions with suppressed macronutrients. J. Plant Nutr. 2015, 7, 1097–1109.
- Chen, L.; Zeng, J.; Xu, D.; Zhao, Z.; Guo, J. Macronutrient deficiency symptoms in Betula alnoides seedlings. Jour. Trop. For. Sci. 2010, 4, 403–413.
- Dussán, S.L.; Villegas, D.A.; Miranda, D. Efecto de la deficiencia de N, P, K, Mg, Ca y B sobre la acumulación y distribución de la masa seca en plantas de guayaba (Psidium guajava L.) var. ICA Palmira II en fase de vivero. Rev. Colom. Cienc. Hortic. 2016, 1, 40–52.
- Mota, R.M.J.; Rocha, P.L.G. Physical and Quality Characteristics of Jupi Pineapple Fruits on Macronutrient and Boron Deficiency. Nat. Res. 2014, 8, 359–366.
- Instituto Nacional de Estadística y Geografía (INEGI). Mapa Digital de México V6.3. Disponible online: http://gaia.inegi.org.mx/mdm6/?coordinates= (consultado el 10 de septiembre de 2019).
- Servicio Meteorológico Nacional. Disponible online: https://smn.conagua.gob.mx/es/climatologia/informacionclimatologica/normales-climatologicas-por-estado (consultado el 12 de septiembre de 2019).
- Papadopoulos, A.P.; Bar-Tal, A.; Silber, A.; Saha, U.K.; Raviv, K. Inorganic and synthetic organic components of soilless culture and potting mixes. In Soilless Culture, Theory and Practices; Raviv, M., Lieth, J.H., Eds.; Elsevier: Amsterdam, NL, USA, 2008; pp. 505–543. ISBN 978-0-444-52975-6.
- Sevil, K.S.; Ertan, E.; Seferoglu, S. Effect of different nutrient solution formulations on morphological and biochemical characteristics of nursery fig trees grown in substrate culture. Sci. Hort. 2007, 2, 20–27.
- Muñoz, R.J.J. Manejo del cultivo de tomate en invernadero. In Manual de Producción de Tomate en Invernadero; Castellanos, J.Z., Ed.; Intagri: Celaya/Ciudad de México, México, 2009; pp. 45–92. ISBN 978-607-95302-0-4.
- Giaccone, M.; Pannico, A.; Scognamiglio, C.; Rivera, M.; Cirillo, C.; Rouphael, Y.; Pascale, S.; Basile, B. Regression model for leaf area estimation in Ficus carica L. Acta Hort. 2017, 1163, 163–168.
- Alcántar, G.G.; Sandoval, V.M. Handbook Chemical Analysis of Vegetal Tissue, Especial Publication No. 10; Mexican Society of Soil Science: Chapingo, Mexico, 1999. (En Español)
- Bremner, J.M. Total nitrogen. In Methods for Soil Analysis. Part 2. Chemical and Microbiological Properties; Norman, A.G., Ed.; American Society of Agronomy Inc.: Madison, WI, USA, 1965; pp. 1149–1178.
- Hawkesford, M.; Horst, W.; Kichey, T.; Lambers, H.; Schjoerring, J.; Skrumsager, I.; White, P. Functions of macronutrients. In Marschner’s Mineral Nutrition of Higher Plants, 3rd ed.; Marschner, H., Ed.; Academic Press: London, UK, 2012; pp. 135–189.
- Taiz, L.; Zeiger, E.; Moller, I.M.; Murphy, A. Plant Physiology and Development, 6th ed.; Sinauer Associates: Sunderland, MA, USA, 2014; ISBN 978-1-60535-255-8.
- Mengel, K.; Kirkby, E.A.; Kosegarten, H.; Appel, T. Principles of Plant Nutrition, 5th ed.; Springer: Berlin/Heidelberg, Germany, 2001.
- Karthika, K.S.; Rashmi, I.; Parvathi, M.S. Biological functions, uptake and transport of essential nutrients in relation to plant growth. In Plant Nutrients and Abiotic Stress Tolerance; Hasanuzzaman, M., Fujita, M., Oku, H., Nahar, K., Hawrylak, B., Eds.; Springer: Berlin/Heidelberg, Germany, 2018; pp. 1–49.
- Alcántar, G.G.; Trejo, T.L.I.; Fernández, P.L.; Rodríguez, M.M. Elementos esenciales. In Nutrición de Cultivos, 2nd ed.; Alcántar, G.G.L.I., Trejo, T.Y.F.C., Gómez, M., Eds.; Colegio de Postgraduados: Ciudad de México, Mexico, 2016; p. 2355. ISBN 978-607-715-324-5.
- Romheld, V. Diagnosis of deficiency and toxicity of nutrients. In Marschner’s Mineral Nutrition of Higher Plants, 3rd ed; Marschner, H., Ed.; Academic Press: London, UK, 2012; pp. 299–312.
- Tanoi, K.; Kobayashi, N. Leaf senescence by magnesium deficiency. Plants 2015, 4, 756–772.
- Engels, C.; Kirkby, E.; White, P. Mineral Nutrition, Yield and Source-Sink Relationships. In Marschner’s Mineral Nutrition of Higher Plants, 3rd ed.; Marschner, H., Ed.; Academic Press: London, UK, 2012; pp. 85–133.
- Soares, S.M.P.; Mendoca, F.M.S.; Cesar, S.P.; Cordeiro, A.J.C.; Silva, J.T. Capsicum annuum var. Annuum under macronutrients and boron deficiencies: Leaf content and visual symptomps. J. Plant Nutr. 2019, 5, 417–427.
- White, P.J. Ion uptake mechanisms of individual cells and roots: Short-distance transport. In Marschner’s Mineral Nutrition of Higher Plants, 3rd ed.; Marschner, H., Ed.; Academic Press: London, UK, 2012; pp. 7–47.
- Farhat, N.; Elkhouni, A.; Zorrig,W.; Smaoui, A.; Abdelly, C.; Rabhi, M. Effects of magnesium deficiency on photosynthesis and carbohydrate partitioning. Acta Physiol. Plant. 2016, 145.
- Guo,W.; Nazim, H.; Liang, Z.; Yang, D. Magnesium deficiency in plants: An urgent problem. Crop. J. 2016, 2, 83–91.
- Lima, T.C.; Freitas, M.S.M.; Mendonça, L.V.P.; Gonçalves, Y.D.S.; Pereira, J.A.P.; Lima, K.F. Visual symptoms of macronutrient and boron deficiency in Cymbopogon citratus. J. Plant Nutr. 2019, 13, 1430–1438.
- Rhodes, R.; Miles, N.; Charles, H.J. Interactions between potassium, calcium and magnesium in sugarcane grown on two contrasting soils in South Africa. Field Crop. Res. 2018, 225, 1–11.
- Veígas, I.D.J.M.; Sousa, G.O.D.; Silva, A.F.D.; Carvalho, J.G.D.; Lima, M.M. Mineral composition and visual symptoms of nutrients deficiencies in long pepper plants (Piper hispidinervum C. DC.). Acta Amazon. 2013, 1, 43–50.
- Veígas, I.J.M.; Silva, L.A.K.; Silva, R.M.F.; Morais, C.R.L.; Capucho, F.D.A.; Oliveira, N.C.F.; Oliveira, C.H.E.; Silva, G.E.M.; Rueil, A.G.A.; Poliana, S.S. Visual symptoms and growth parameters linked to deficiency of macronutrients in young Swietenia macrophylla plants. J. Food Agric. Environ. 2012, 1, 937–940.
- Ribeiro, C.A.C.; Gomes, W.L.; Loges, V.; Arruda, C.M.F.; Souza, A.F.A. Macronutrients deficiency in Heliconia psittacorum X Heliconia spathocircinata ‘Golden Torch’. Rev. Ciência Agron. 2015, 2, 258–265.
- Rodríguez, M.M.N.; Tejo, T.L.I.; Alcántar, G.G. Acceso, absorción y transporte nutrimental. In Nutrición de Cultivos, 2nd ed.; Alcántar, G.G.L.I., Trejo, T.Y.F.C., Gómez, M., Eds.; Colegio de Postgraduados: Ciudad de México, México, 2016; pp. 153–182. ISBN 978-607-715-324-5.
- Brown, P. Seasonal variations in fig (Ficus carica L.) leaf nutrient concentrations. HortScience 1994, 8, 871–873.
- Moreno, D.A.; Pulgar, G.; Víllora, G.; Romero, L. Nutritional diagnosis of fig tree leaves. J. Plant Nutr. 1998,12, 2579–2588.
- Sun, R.; Sun, L.; Jia, M. Analysis of psoralen and mineral elements in the leaves of different fig (Ficus carica L.) cultivars. Acta Hort. 2017, 1173, 293–296.
- Mendoza, C.V.M.; Pineda, P.J.; Vargas, C.J.M.; Hernández, A.E. Nutrition of fig (Ficus carica L.) under hydroponics and greenhouse conditions. J. Plant Nutr. 2019, 11, 1350–1365.



Aún no hay comentarios sobre el artículo